
题目列表(包括答案和解析)
20.(12分)(2008·山东青岛3月)A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)B的原子结构示意图__________;
(2)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式);
(3)C与D形成的化合物的化学式是__________,它的性质决定了它在物质的分类中应属于__________;请写出该化合物的水化物的电离方程式__________;
(4)F的单质在反应中常作__________剂,该单质的水溶液与E的低价氧化物反应的离子方程式为______________________________。
解析:根据X的水溶液显碱性,得到B为N,A为H;D的简单阳离子为10e-结构,且在同周期简单离子中半径最小,推出D为Al元素;E
次外层电子数必须大于2,则E的核外电子排布为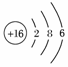 ,E为S元素;F的原子序数比E大且为主族元素,F只能是Cl元素,即可推出C为O元素。其余可迎刃而解。
,E为S元素;F的原子序数比E大且为主族元素,F只能是Cl元素,即可推出C为O元素。其余可迎刃而解。
答案:(1)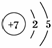 (2)H2O
(2)H2O
(3)Al2O3 两性氧化物
H2O+H++AlOAl(OH)3Al3++3OH-
(4)氧化 SO2+Cl2+2H2O===4H++SO+2Cl-
19.(8分)(2009·宿州模拟)有A、B、C、D、E五种短周期元素,其元素特征信息如下表
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质。 |
|
B |
阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
|
C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
|
D |
其氢氧化物和氧化物都有两性,与C同周期 |
|
E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C________,E________。
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)____________________。
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:_____________________。
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:________________。
解析:由元素信息知:A是氢元素,B是氧元素;C与氧可形成两种离子化合物,且与B的阴离子有相同的电子层结构,则C是钠元素,D是铝元素,E是氯元素。
答案:(1)钠 氯
(2)r(O2-)>r(Na+)>r(Al3+)
(3)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Al+2OH-+2H2O===2AlO+3H2↑
18.根据中学化学教材所附元素周期表判断,下列叙述中不正确的是 ( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
答案:C
第Ⅱ卷(非选择题,共46分)
17.有五组同族元素的物质,在101.3kPa时测定它们的沸点(°C)如下表所示:
|
① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2
184.0 |
|
③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O
100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中正确的是 ( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
C.第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.上表物质中HF和H2O由于氢键的影响,其分子特别稳定
答案:C
16.(2009·北京)甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是 ( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中氢元素质量比相同,则丁中一定含有-1价的元素
解析:据题意可得出:甲为H2S,乙为SiH4,丙为C2H4或CH3OH,丁为H2O2。
答案:D
15.(2009·四川)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是 ( )
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
解析:由X、Y相邻且X的核电荷数是Y核外电子数一半可知X为O、Y为S,又2所以M为第ⅠA族元素,并且X、Y、Z、M原子序数依次增大,则M为K,Z为Cl,故A中应为还原性:H2O<HCl<H2S,B中应为:离子半径:S2->Cl->K+>O2-,C中YX2为SO2、M2Y为K2S,而K2S为离子化合物,故C项错误,D中Cl元素最高价氧化物的水化物的化学式为HClO4,即D项正确。
答案:D
14.(2009·广东韶关4月)几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是 ( )
A.L、M的单质与稀硫酸反应速率:M>L
B.R的氧化物对应的水化物可能具有两性
C.T、Q的氢化物常态下均为无色气体
D.L、Q形成的简单离子核外电子数相等
解析:根据化合价和原子半径的周期性变化可知,T为氧,Q为S,L为Mg,M为Al,R为Be。B项,Be的氧化物BeO与Al2O3性质相似。C项,H2O为液态,A项应为L>M。D项,Mg形成Mg2+,S形成S2-,简单离子核外电子数不同。
答案:B
13.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子的少1。下列说法正确的是 ( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Y>Z>X
答案:A
12.(2009·潍坊模拟)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是 ( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的溶液能使酚酞试液变红
B. C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A-E的顺序依次增大
答案:D
11.下列叙述正确的是 ( )
A.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1?2
B.离子化合物中一定不含共价键
C.某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR
D.元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com