
题目列表(包括答案和解析)
22.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出很多炼铁的方法。
Ⅰ.某研究性学习小组查阅了工业炼铁的有关资料后,发现目前多采用高炉炼铁这种主流方法,其生产示意图如下,请回答下列问题:

(1)已知铁矿石中有一些难熔化的脉石(SiO2),在铁矿石中加入一定比例的石灰石就是为了除去这些脉石,形成的物质就是炉渣的主要成分,请写出有关反应的化学方程式:________________________________________________________________________,
________________________________________________________________________;
(2)铁矿石中加入一定比例的焦炭的目的是生成还原剂CO,请写出得到CO的化学方程式:
__________________,__________________;
(3)热空气从高炉下部通入,而炉料从高炉顶部投入,这样操作的主要目的是__________________________________________________。
Ⅱ.该小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
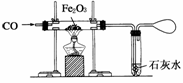
(1)硬质玻璃管中的现象__________________。
(2)如何验证有单质铁生成__________________。
(3)装置末端气球的作用为__________________,实验结束时,应该先停止加热还是先停止通入CO,解释其理由____________________________________________________。
[解析] Ⅰ.用石灰石除脉石的原理可以从工业制玻璃的原理迁移过来;焦炭在进风口附近与热空气接触,燃烧生成CO2,CO2上升跟赤热的焦炭反应生成CO;在炉腰以上的位置与Fe2O3反应得到单质铁,热空气由下向上
升,而炉料由上向下落,使它们能够充分接触,有利于反应充分进行和热量充分利用;
Ⅱ.CO还原Fe2O3得到单质铁,现象是由红棕色变为黑色,气球的作用是收集尾气CO。为了防止生成的铁再被氧化,应先停止加热。
[答案] Ⅰ.(1)CaCO3CaO+CO2↑
CaO+SiO2CaSiO3
(2)C+O2CO2 CO2+C2CO
(3)使炉料和热空气充分接触,使反应得以顺利进行,且有利于热交换,使热能得以充分利用
Ⅱ.(1)红棕色变为黑色
(2)取少量生成物放于试管中加少量盐酸,若产生无色无味气体,则证明生成了单质铁
(3)收集CO防止污染空气 先停止加热防止生成的铁再次被氧化
21.(2009·亳州模拟)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
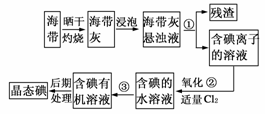
(1)步骤①的实验操作名称是________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是
________;
A.CCl4与水不互溶
B.CCl4可与I2发生取代反应
C.CCl4的密度比水大
D.CCl4不易燃烧,可作灭火剂
E.碘在CCl4中的溶解度比在水中大很多
(4)步骤②中反应的离子方程式是____________;
(5)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:__________________________________。
[解析] (1)过滤海带灰的悬浊液即得残渣和含I-的溶液。
(2)操作①过滤中缺少漏斗,操作③萃取中缺少分液漏斗。
(3)萃取剂选择的原则是:萃取剂不能与原溶剂相互溶解,被萃取物质在萃取剂中的溶解度要比在原溶剂中的溶解度大得多,CCl4符合萃取剂的选择条件。
(5)根据淀粉遇I2变蓝色的性质,可选用淀粉来检验水溶液中是否还含有I2。
[答案] (1)过滤 (2)漏斗、分液漏斗
(3)A、E
(4)Cl2+2I-===2Cl-+I2
(5)取少量待测液注入试管中,滴加淀粉溶液,若溶液变蓝色,说明水溶液中存在I2,否则水溶液中无I2
19.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如图:
铝土矿①加过,量盐酸过滤不溶物,\o(\s\up7(滤液(甲
(1)写出步骤①中发生反应的化学方程式:________________________________。
(2)写出滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
[答案] (1)Al2O3+6HCl===2AlCl3+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
(2)AlCl3+4NaOH===NaAlO2+2H2O+3NaCl
18.在实验室里用铁屑、氧化铜、稀硫酸为原料制取铜,有下列两种途径:
(1)FeH2Cu
(2)CuOCuSO4Cu
若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是 ( )
A.消耗氧化铜的质量相同
B.消耗铁的质量相同
C.消耗硫酸的质量相同
D.生成硫酸亚铁的质量相同
[答案] A
17.在理论上我们可以用电解熔融KCl的方法来制备金属钾,而实际上我们不用此法制备钾,而用熔融状态下的KCl与Na反应并及时抽走钾蒸气的方法制备钾,可能的原因是:①钾易熔于熔融的钾盐中;②钾蒸气易逸出而污染环境;③钾被氧化后的产物与K作用具有爆炸性;④抽走钾的蒸气有利于钠与熔化的KCl反应,其中正确的是 ( )
A.全部 B.①③ C.①④ D.②④
[答案] A
16.NaCl溶液中含有Ca(HCO3)2、MgSO4、CaSO4等杂质,其去除方法正确的是( )
A.Ba(OH)2溶液―→Na2CO3溶液―→盐酸
B.Ba(OH)2溶液―→盐酸―→Na2CO3溶液
C.Na2CO2溶液―→Ba(OH)2溶液―→盐酸
D.盐酸―→Na2CO3溶液―→Ba(OH)2溶液
[答案] A
15.用铝热剂冶炼金属,是利用了铝的 ( )
①还原性 ②既与H+反应,也与OH-反应
③导电性 ④反应过程中放出大量的热
A.① B.①②③
C.①④ D.①②③④
[答案] C
14.用铝热法还原下列氧化物,制得金属各1 mol,消耗铝最少的是 ( )
A.MnO2 B.WO3 C.Cr2O3 D.Co3O4
[答案] D
13.(2008·广东高考)海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是 ( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com