
题目列表(包括答案和解析)
5.将相同质量的镁条分别放在:①氧气 ②空气 ③氮气 ④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是
( )
A.②<①<③<④ B.④=①=②=③
C.③<②<①<④ D.③<①<②<④
[解析] 本题考查Mg在O2、空气、N2、CO2中燃烧的反应以及定量分析问题的能力。
Mg在氧气中:2Mg+O2

 2MgO
2MgO
Mg在空气中:2Mg+O2

 2MgO(主)
2MgO(主)
3Mg+N2

 Mg3N2(微量)
Mg3N2(微量)
Mg在二氧化碳中:2Mg+CO2 
 C+2MgO
C+2MgO
设有1 mol Mg完全反应:
①Mg-→MgO-→O-→增重16 g
②Mg -→Mg3N2-→MgN-→N-→增重9.3 g
③Mg-→MgO+C-→O+C-→增重22 g
故产物质量大小顺序为④>①>②>③。
[答案] C
4.下列溶液能与镁反应生成氢气的是
( )
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.饱和石灰水
[解析] 镁是活泼金属,常温下与水不反应,可以与热水缓慢反应,常温下与酸或酸性物质反应能生成氢气,因NH4Cl水解显酸性:NH+H2O
 NH3·H2O+H+,故NH4Cl溶液能与镁反应生成氢气。
NH3·H2O+H+,故NH4Cl溶液能与镁反应生成氢气。
[答案] A
3.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是
( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
[解析] B项,蒸发过程只发生物理变化;C项,海水中的钾元素为化合态,得到单质钾为化学变化;D项,潮汐是涨潮、落潮的过程,潮汐发电过程中无化学变化。
[答案] A
2.下列海水中的元素,对其用途的说明中,不正确的是
( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.铀用于制氢弹
D.镁用于制造飞机、汽车
[解析] 铀用做核燃料,可以制造原子弹;H、H才是用于制造氢弹。
[答案] C
1.下列叙述不正确的是
( )
A.地球上99%的溴元素以溴单质形式存在于海洋中
B.在每升海水中含量低于1 mg的元素称为海水中的微量元素
C.海水是锂元素的一个重要来源
D.世界上生产的镁大部分来自海水
[解析] 对A项,海水中溴元素主要以化合态形式存在于海洋中,而不是以游离态形式(即单质)存在,故A错误,因此不正确的选A。考查同学们对海水中元素的存在形式及含量的常识性了解。
[答案] A
15.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
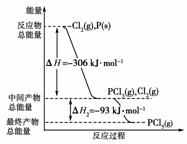
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是____________________________________;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。
原因是_____________________________________________________________________ _____________________________________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5(g)的ΔH3=______,P和Cl2一步反应生成1 mol PCl5(g)的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
[解析] (1)、(2)中ΔH=生成物的总能量-反应物的总能量,不难写出两个热化学方程式。分解率α1=×100%=25%;升温,化学平衡向吸热反应方向移动,因PCl5的分解要吸热,故升温,分解率增大,α2>α1。
(3)降温,化学平衡向放热反应方向移动。
(4)根据盖斯定律:一个化学反应不论是一步完成还是多步完成,其热效应总是相同的。
[答案] (1)Cl2(g)+P(s)===PCl3(g) ΔH=-306kJ/mol
(2)PCl5(g)PCl3(g)+Cl2(g) ΔH=+93 kJ/mol
25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ/mol 等于
14.A-G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:A(s)+B(g)===C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
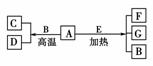
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)===G(g) ΔH=-393.6 kJ·mol-1
C(g)+O2(g)===G(g) ΔH=-283 kJ·mol-1
D(g)+O2(g)===B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由_________________________________ _______________________________________________________________________________________________________________。
(3)写出A+O2-→C的热化学方程式:
________________________________________________________________________。
[解析] (1)由A(s)+B(g)===C(g)+D(g)
ΔH=+131.4 kJ·mol-1,
知n(A)==mol
M(A)==12 g·mol-1,故A为碳,B为H2O,C为CO,D为H2,G为CO2,E为浓H2SO4或浓HNO3。
(2)可把3个热化学方程式具体写为:
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1
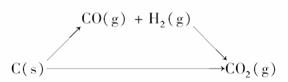
两种途径反应热分别为:-283 kJ·mol-1-242 kJ·mol-1+131.4 kJ·mol-1=-393.6 kJ·mol-1和-393.6 kJ·mol-1,可见是相等的。
(3)将C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1和CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1两式相减即得C+O2-→CO的热化学方程式。
[答案] (1)碳
(2)不正确,因为1 mol A与O2直接燃烧放出的热量为393.6 kJ,而1 mol A先与B反应生成C和D,C和D再与O2反应,共放热量-131.4 kJ+283 kJ+242 kJ=393.6 kJ,两者相同
(3)C(s)+O2(g)===CO(g) ΔH=-110.6 kJ·mol-1
13.(2010年嘉兴质检)(1)①根据下列图示,写出反应的热化学方程式____________。
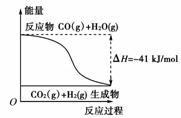
②根据如图所示情况,判断下列说法中正确的是
( )
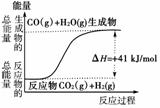
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ/mol
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是____ ___________________________________________________________________________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:________________________________________________________________________ _______________________。
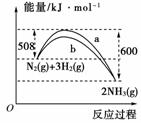
a、b两条曲线产生区别的原因很可能是__________________________________。
[解析] (1)①图表示反应放出41 kJ的热量。
②以图示形式将反应CO2(g)+H2(g)===CO(g)+H2O(g)的质变与能变呈现出来,并要求判断反应类型及ΔH情况。根据所给图示可知,A选项将反应的反应物与生成物弄反了,故不对;生成物的能量比反应物的能量高,故该反应为吸热反应,B选项正确,则C选项错误;D选项未限定H2O的物质的量,故不对。答案为B。
(3)b反应中使用催化剂,可以降低反应的活化能,但反应的热效应不会改变。
[答案] (1)①CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ/mol
②B
(2)S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol
(3)N2(g)+3H2(g)
 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
a不使用催化剂,b使用了催化剂
12.将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是
( )
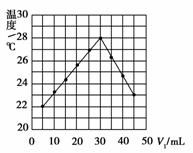
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
[解析] 中和反应为放热反应,B对;中和反应有水生成,但有水生成的不一定是放热反应,如氯化铵晶体与氢氧化钡晶体反应是吸热反应,D错;从图中分析可知,当加入5 mL HCl溶液和45 mL NaOH溶液时,反应后的溶液温度为22 ℃,故实验时环境温度小于22 ℃,A错;加入HCl溶液30 mL时反应放热最多,应是酸碱正好中和,故c(NaOH)=1.0 mol·L-1×30 mL/20 mL=1.5 mol·L-1,C错。
[答案] B
11.(2009年天津高考)已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
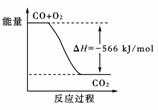
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
( )
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
[解析] CO的燃烧热是283 kJ/mol,A项数据的单位不对。B项的图象中,CO和CO2的物质的量都应是2 mol。由题中的反应得:2Na2O2(s)+2CO2(g)===2Na2CO3(s)+O2(g) ΔH=-452 kJ/mol,当反应物中的CO2为固态时,因为固体变成气体要吸热,所以反应放出的热量减少,而放热反应的ΔH是负值,所以C项正确。根据题中两个反应得:Na2O2(s)+CO(g)===Na2CO3(s) ΔH=-509 kJ/mol,即CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com