
题目列表(包括答案和解析)
0.02 mol×64 g/mol=1.28 g。
[答案] (1)不变 (2)Zn-→Zn2++2e- (3)1.28 Cu2++2e--→Cu
13.在50 mL 2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化__________________。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是____________________。
(3)如果不考虑H+在阴极上放电,当电路中有0.04 mol电子通过时,阴极增重________g,阴极上的电极反应式是__________________。
[解析] (1)、(2)类似于电镀原理。(3)由Cu2++2e--→Cu可知:2 mol e--1 mol Cu,故阴极析出Cu:
12.实验室用铅蓄电池作电源电解AgNO3溶液,电池两极发生如下反应:正极:PbO2+4H++SO+2e--→PbSO4+2H2O,负极:Pb+SO-→PbSO4+2e-,当电解析出2.16 g Ag单质时,电池内消耗H2SO4的物质的量是
( )
A.0.01 mol B.0.02 mol
C.0.03 mol D.0.04 mol
[解析] 首先确定析出Ag与转移电子数的关系,其次抓住电解进行时,电池两极上转移的电子与电解池两极上得失的电子数是相等的。析出Ag:=0.02 mol。由Ag++e--→Ag得电解池中两极上转移的电子数为0.02 mol。蓄电池的总反应(两电极反应式相加):
Pb+Pb
2e-
2H2SO42PbSO4+2H2O。每转移2 mol电子消耗2 mol H2SO4,现转移0.02 mol电子,消耗0.02 mol H2SO4。
[答案] B
11.(2010年莱芜质检)某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1,用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
( )
A.阴极自始至终只析出H2
B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水
D.溶液pH不断增大,最后为7
[解析] 由题意知:n(H+)∶n(Cl-)=2∶3,在阴极放电的是H+,在阳极放电的是Cl-,Cl-放电完后是OH-。因此反应开始在两极放电的是H+、Cl-,相当于电解盐酸。由H2SO4电离的H+放电完后,在两极放电的是由水电离的H+和剩余的Cl-,相当于电解NaCl的水溶液。Cl-放电完后,在两极放电的是由水电离的H+和OH-,相当于电解水。故A、B、C是正确的。溶液pH的变化是不断增大,但最后溶质是NaOH和Na2SO4,pH不会为7。
[答案] D
10.某同学按下图所示的装置进行电解实验。下列说法正确的是(多选)
( )
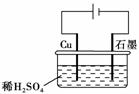
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
[解析] 电解时铜为阳极,阳极铜失电子而溶解,A错;阴极上先是H+得电子放出H2,随着阳极铜的溶解,溶液中Cu2+浓度增大,后是Cu2+得电子析出Cu,所以B、C都对,D错。
[答案] BC
9.(2009年重庆高考)如下图所示,下列叙述正确的是
( )
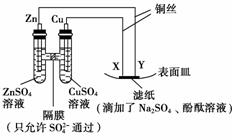
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
[解析] 根据装置图和电化学知识可知,Zn、Cu及ZnSO4、CuSO4溶液构成原电池,用该原电池提供的电能电解Na2SO4溶液(其实质是电解H2O)。Y极接电源的负极,故Y为阴极,溶液中H2O电离产生的H+在该极获得电子发生还原反应产生H2,同时产生OH-:2H2O+2e--→2OH-+H2↑,Y极附近出现红色。X极接电源的正极,故X为阳极,水电离产生的OH-在该极失去电子发生氧化反应产生O2,同时产生H+:H2O-→O2↑+2H++2e-。综合上述只有选项A正确。
[答案] A
8.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
( )
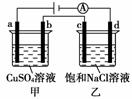
A.乙池中d的电极反应为:2Cl--→Cl2↑+2e-
B.a、c两极产生气体的物质的量相等
C.甲、乙两池中溶液的pH均保持不变
D.乙池中发生的反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑
[解析] A项,d电极是阴极,应该是溶液中的阳离子放电,即2H++2e--→H2↑,故不正确;B项,a、c均为阳极,甲池中是OH-放电产生O2,乙池中是Cl-放电产生Cl2,故产生气体的物质的量不相等,不正确;C项,甲池电解硫酸铜溶液,溶液的pH减小,乙池电解氯化钠溶液,溶液的pH增大,故不正确;D项正确。
[答案] D
7.用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是(多选)
( )
A.AgNO3[AgNO3] B.NaOH[H2O]
C.KCl[KCl] D.CuSO4[CuO]
[解析] A选项4AgNO3+2H2O4Ag+O2↑+4HNO3,脱离反应体系的物质是4Ag+O2,相当于2Ag2O,所以应当加入适量的Ag2O才能复原(加入AgNO3,会使NO的量增加)。B选项2H2O2H2↑+O2↑,脱离反应体系的是2H2+O2,相当于2H2O,加入适量水可以复原。C选项2KCl+2H2O2KOH+H2↑+Cl2↑,脱离反应体系的是H2+Cl2,相当于2HCl,应通入适量HCl气体才能复原。D选项2CuSO4+2H2O2H2SO4+2Cu+O2↑,脱离反应体系的是2Cu+O2,相当于2CuO,加入适量CuO可以复原。
[答案] BD
6.下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是
( )
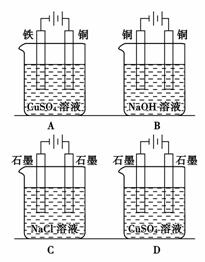
[解析] 对几个装置进行分析:A属于在铁上镀铜,溶液的浓度、pH不变;B铜作阳极溶解,变成Cu2+落入溶液,随即消耗2个OH-生成Cu(OH)2,阴极上H+得电子,生成2个OH-,NaOH浓度有所上升(水减少),但pH变化不大;C是电解饱和食盐水,生成NaOH,pH增大比较明显;而D则生成H2SO4,pH明显下降。
[答案] D
5.(2010年芜湖质检)如下图所示,x、y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无味的气体放出,符合这一情况的是
( )
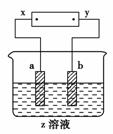
|
|
a极板 |
b极板 |
x电极 |
z溶液 |
|
A |
锌 |
石墨 |
负极 |
CuSO4 |
|
B |
石墨 |
石墨 |
负极 |
NaOH |
|
C |
银 |
铁 |
正极 |
AgNO3 |
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
[解析] 由题意知a极板质量增加,a应为阴极,则b为阳极,x为电源的负极,y为电源正极。A选项中a极板为阴极,b极板为阳极,参考各个选项知,A项符合,电解时,a极有Cu附着,b极有O2放出;B项不符合,电解时a极无质量变化;C项阳极为Fe,为活性电极,电解时Fe在阳极放电溶解,无气体生成,故C项不符合;D项电解时,Cl-在阳极放电生成Cl2,Cl2为黄绿色有刺激性气味的气体,与原题题意不符合。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com