
题目列表(包括答案和解析)
137. NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
|
盐酸体积(mL) |
8 |
15 |
20 |
50 |
x |
120 |
150 |
|
生成CO2体积(mL) |
0 |
112 |
224 |
896 |
2240 |
2240 |
2240 |
试求:
(1)当加入盐酸后,生成CO2体积不再增加时,x的最小值为 。
(2)未变质前NaHCO3的质量。
(3)部分变质后样品A中的成分及各成分的物质的量。
136.把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是( )
A.加入的NaOH质量一定最大
B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
135.某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、Ca2+、Cl-、ClO- B.Cu2+、Fe2+、NO3-、SO42-
C.K+、NH4+、Cl-、SO42- D. Na+、K+、Cl-、SO42-
134.钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
133.向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)( )
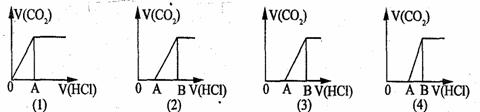
A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.2)图显示M中c(NaHCO3)>c(Na2CO3) D.(4)图显示M中c(NaHCO3)>c(Na2CO3)
133.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是
;
(Ⅰ)乙装置中的试剂是
;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入 气体,再从b管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
132.下列有关Na2CO3和NaHCO3性质的比较中,不正确的是( )
A.对热稳定性:Na2CO3 >NaHCO3 B.常温时水溶性:Na2CO3 >NaHCO3
C.与稀盐酸反应的快慢:Na2CO3 >NaHCO3 D.相对分子质量:Na2CO3>NaHCO3
131. NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
|
盐酸体积(mL) |
8 |
15 |
20 |
50 |
x |
120 |
150 |
|
生成CO2体积(mL) |
0 |
112 |
224 |
896 |
2240 |
2240 |
2240 |
试求:
(1)当加入盐酸后,生成CO2体积不再增加时,x的最小值为 。
(2)未变质前NaHCO3的质量。
(3)部分变质后样品A中的成分及各成分的物质的量。
130.把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是 ( )
A.加入的NaOH质量一定最大
B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
129. 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com