
题目列表(包括答案和解析)
17.(10分)一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如下图所示[肼(N2H4)和硼烷(B5H9)为传统火箭燃料]。
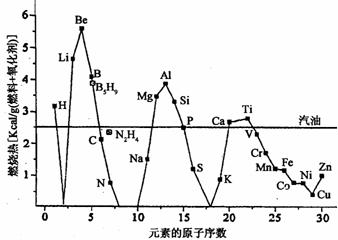
请回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是________________(填写元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是_____________________________(填一项)。
(2)使金属在较低温度下燃烧的关键技术之一是将其制成纳米、微米级的颗粒。如此,不仅降低了金属燃料的燃点,也使得燃烧更为容易和充分,其原因是____________
(3)Be粉和MnO2粉末在高温下可以反应(类似铝热反应),请写出反应的化学方程式_________________;根据图示推测可能的原因是________________________
16.(10分)⑴高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:

①试管中(填产生沉淀或气体及反应速率等相关现 象)
②试管中气球大小(包含试管) 体积之比约为(填最简单整数比)I:II =____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。
甲得出的结论是否正确____________ (填正确或不正确)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
50mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
50mL水 |
3.2g Na2CO3固体 |
20℃ |
23.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液15mL |
20℃ |
21.2℃ |
|
⑤ |
50mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
24.4℃ |
请你帮助填写相关内容:
①该研究报告的题目是《________________________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出三条结论:
a:Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应
b:NaHCO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
15.乙醇汽油是普通汽油与燃料乙醇调和而成,它可以有效改善油的性能和质量,降低CO、碳氢化合物等主要污染物的排放。乙醇的燃烧热是1366.8kJ/mol。燃烧1mol 这种乙醇汽油生成液态水,放出的热量为QkJ。测得该汽油中乙醇与汽油的物质的量之比为1:9。有关普通汽油(CxHy)燃烧的热化学方程式正确的是 ( )
A.CxHy(l)+ (x + y/4)O2(g)=x CO2(g) + y/2 H2O(l);△H=(-Q + 1366.8)kJ/mol。
B.CxHy(l)+ (x + y/4)O2=x CO2(g) + y/2 H2O(l);△H=-9Q/10kJ/mol。
C.CxHy(l)+ (x + y/4)O2(g)=x CO2(g) + y/2 H2O(l);△H=-9Q /10kJ/mol。
D.CxHy(l)+ (x + y/4)O2(g)=x CO2(g) + y/2 H2O(l);△H=(-10Q/9 + 151.9)kJ/mol
第Ⅱ卷(非选择题 共55分)
14.(2010浙江卷)下列热化学方程式或离子方程式中,正确的是: ( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应: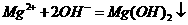
D.氧化铝溶于NaOH溶液:
13.已知稀溶液中反应:H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol下列结论正确的是 ( )
A.含1mol NaOH的稀溶液与足量稀盐酸反应吸收57.3kJ热量
B.含1mol Ba(OH)2的稀溶液与足量稀硫酸反应中和热为-57.3kJ/mol
C.浓硫酸与含1mol NaOH的稀溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出热量小于57.3kJ
12.从以下反应:①CaCO3 + 2HCl=CaCl2 + H2O + CO2↑;②C6H5ONa + CO2 + H2O→C6H5OH + NaHCO3;③2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2↑+ 8H2O;④3KBr + Cl2=2KCl +Br2 推出结论为 ( )
A.酸性:C6H5OH>HCl>H2CO3
B.阴离子结合质子能力:Cl―>HCO3―>C6H5O-
C.还原性:Cl―>Br―>Mn2+
D.氧化性:KMnO4>Cl2>Br2
11.下列说法正确的是 ( )
A.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2
B.SO2气体使品红溶液褪色,表现了SO2的氧化性
C.浓盐酸和MnO2反应时,浓盐酸中的HCl全部被氧化
D.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移
10.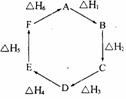 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发
生-系列转化,由右图判断下列关系错误的是 ( )
A.A→F, △H=-△H6
B.△H 1+△H 2+△H 3+△H 4+△H 5+△H 6=1
C.C→F, |△H|=|△H1+△H2+△H6 |
D.|△H1+△H2+△H3|=|△H4+△H5+△H6 |
9.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
8.一些烷烃的燃烧热(kJ/mol)如下表:
|
化合物 |
燃烧热 |
化合物 |
燃烧热 |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是 ( )
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8KJ/mol
C.正戊烷的燃烧热大约在3540 KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com