
题目列表(包括答案和解析)
21.某化学实验小组为测定三个不规则容器的容积,甲、乙、丙三个小组分别利用以下几个实验完成。试回答有关问题: ( )
(1)甲组:先用托盘天平,称得容器的质量为m g,再充满H2O,称得容器和H2O的总质量为n g,则容器的容积为________。
(2)乙组:先用排空气法充满一容器标准状况下的HCl气体,然后做喷泉实验,(溶液不扩散)所得溶液用标准NaOH(0.10 mol/L)溶液滴定,消耗NaOH溶液20 mL。
①容器的容积为________。
②该实验原理可能存在的缺陷是__________________________________________。
(3)丙组:把35.1 g NaCl放入500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100 mL,该溶液恰好与20 mL 0.100 mol·L-1 AgNO3溶液完全反应。试计算该容器的体积。
解析:AgNO3+NaCl===AgCl↓+NaNO3
n(NaCl)=n(AgNO3)=0.100 mol·L-1×0.02 L=0.002 mol,
m(NaCl)=0.002 mol×58.5 g·mol-1=0.117 g,
V容器=100 mL×=30000 mL=30 L。
答案:(1)(n-m) mL
(2)①44.8 mL ②排空气法收集气体不纯净,测定值偏低 (3)30 L
74.5 g/mol+119 g/mol)x=38.7 g
x=0.2 mol
∴(1)n(Cl2)==0.1 mol
即2.24L
(2)原KBr浓度:=2 mol/L
答案:(1)2.24 L (2)2 mol/L
20.(2009·石家庄市高三第一学期调研)将一定量的氯气通入200 mL的KBr溶液中,充分反应后将溶液蒸干,得到38.7 g干燥的固体物质。经测定该固体物质中K+与Br-的物质的量之比为2:1,求:
(1)通入的氯气在标准状况下的体积;
(2)原KBr溶液的物质的量浓度。
解析:因n(K+)?n(Br-)=2?1,则38.7 g固体为KCl和KBr混合物,且n(KCl)=n(KBr)设为x
19.(2008·郑州模拟)某校环保小组处理污水样品,需配制250 mL 0.1 mol·L-1的盐酸溶液。
(1)在如下图所示仪器中,配制上述溶液肯定不需要的是________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
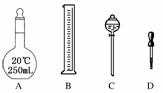
(2)怎样检查容量瓶是否漏水?________。
(3)在容量瓶的使用方法中,下列操作不正确的是__________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1-2 cm处,用滴管加蒸馏水至标线
D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1-2 cm处,用滴管加蒸馏水至标线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
解析:B容量瓶用蒸馏水洗净后,若再用待配溶液润洗,会造成溶质的量偏多,结果偏高。C、D无论是固体或液体溶质,溶解均应在烧杯中进行,而不可在容量瓶中进行。
答案:(1)C 玻璃棒、烧杯 (2)将A瓶塞打开,加入少量水,塞好瓶塞,倒转不漏水,然后正放,把瓶塞旋转180˚,再倒转不漏水,则说明该容量瓶瓶塞严密 (3)B、C、D
18.(2007·上海,30)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为________。
(2)所得溶液中Cl-的物质的量为________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)?n(H2)=________。
解析:(1)n(NaOH)=0.1 L×3.00 mol·L-1=0.3 mol,故NaOH的质量为m1(NaOH)=0.3 mol×40 g·mol-1=12 g,溶液的质量为m2=10 mL×1.12 g·mL-1=112 g。
所以NaOH溶液的质量分数为w(NaOH)=×100%=×100%=10.7%。
(2)根据Na守恒n(NaCl)=n(NaOH)-n(NaClO)=0.3 mol-0.0500 mol=0.25 mol,即n(Cl-)=0.25 mol。
(3)从所给物质间的反应情况看,可以将原来的Cl2分为两部分,一部分发生反应①H2+Cl2===2HCl,此部分转化为NaCl,另一部分发生反应②Cl2+2NaOH===NaCl+NaClO+H2O,从反应②可推出该部分Cl2的物质的量,根据NaOH守恒发生反应①的Cl2为
n2(Cl2)=n(NaOH)-n(NaClO)×2
=0.3 mol-0.0500 mol×2=0.2 mol,
此部分需要H2也为0.2 mol,即n(H2)=0.2 mol,
因此参加反应的Cl2和H2物质的量之比为
==3?2。
答案:(1)10.7% (2)0.25 (3)3?2
17.(2008·唐山模拟)在一定量AgNO3溶液中逐滴加入某浓度的盐酸,直到沉淀恰好完全为止。已知所形成溶液的质量等于原AgNO3溶液的质量,则所加盐酸中HCl的质量分数为________。
解析:这是无数据计算题型,按题意可作如下分析:
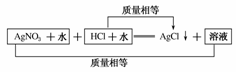 即可将AgCl的相对分子质量看做原盐酸的质量,那么w(HCl)=×100%=25.4
%
即可将AgCl的相对分子质量看做原盐酸的质量,那么w(HCl)=×100%=25.4
%
无数据计算题型,关键在于根据质量守恒,找出质量守恒的关系式,即可顺利解答,若知道溶液的密度,也可求得溶液的物质的量浓度。
答案:25.4%
16.(2007·泰安模拟)浓度为0.5 mol·L-1某金属阳离子Mn+的溶液10.00 mL,恰好与0.4 mol·L-1的NaOH溶液12.50 mL完全反应,生成沉淀,则n等于 ( )
A.1 B.2
C.3 D.4
解析:n(Mn+=0.50 mol·L-1×10.00 mL×10-3 L·mL-1=5.00×10-3 mol
n(OH-)=5.00×10-3 mol
据题意:Mn++nOH-===M(OH)n↓
1 mol n mol
由此看出:n=1
答案:A
15.将34.2 g C12H22O11(蔗糖)溶解在100 mL水中。关于所组成的溶液,下列叙述中正确的是 ( )
A.该溶液中溶质的物质的量浓度为1 mol·L-1
B.该溶液溶质的质量分数为×100%
C.该溶液中溶质的物质的量浓度的确定还需知道溶液的密度
D.该溶液溶质的质量分数的确定还需知道溶液的密度
答案:BC
14.(2008·福州模拟)一定量的质量分数为14%的KOH溶液,若蒸发掉100 g水后,其质量分数变为28%,体积为125 mL,且蒸发过程中无晶体析出,则浓缩后的KOH溶液的物质的量浓度为 ( )
A.2.2 mol·L-1 B.4 mol·L-1
C.5 mol·L-1 D.6.25 mol·L-1
解析:解法一 设原溶液质量为x,浓缩前后溶质的质量守恒:x×14%=(x-100 g)×28%
x=200 g
则c(KOH)==4 mol·L-1
解法二 设溶质的质量为x,则
×100%=28%
x=28 g
c(KOH)==4 mol·L-1
答案:B
13.(2009·江苏扬州)50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水中加入一定量的水稀释成0.5 cmol·L-1,则加入水的体积为 ( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
解析:设加水的体积为V,由稀释前后溶质的物质的量不变可得:×c mol·L-1=×0.5 c mol·L-1。化简可得:V·ρ+50ρ=100·ρ后,V=(100·-50)mL,因为氨水的密度随浓度的减小而增大,即ρ后>ρ,所以V>50 mL,C正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com