
题目列表(包括答案和解析)
90.已知:①向Mn4晶体滴加浓盐酸,产生黄绿色气体;②向Fel2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉I试纸上,试纸变蓝色。
下列判断正确的是( )
A 上述实验证明氧化性:Mn4->l2>Fe3+>I2
B 上述实验中,共有两个氧化还原反应
实验①生成的气体不能使湿润的淀粉I试纸变蓝
D 实验② 证明Fe2+既有氧化性又有还原性
证明Fe2+既有氧化性又有还原性
贵州省贵阳一中2011届高三化学一轮复习专题题库:
89.(铀)是重要的核工业原料,常见化合价有+4和+6。硝酸铀酰[2(N3)2]加热可发生如下分解: 2(N3)2→XY+N2↑+2↑。在600时,收集满一试管气体产物,并将试管倒扣于水中,气体全部被吸收,水充满试管。则生成铀的氧化物中铀元素的化合价是(B)
A.+4 B.+6 .+4和+6 D.0
88.已知在热的碱性溶液中,Nal发生如下反应: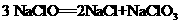 ,在相同条件下
,在相同条件下 也能发生类似的反应,其最终产物是( )
也能发生类似的反应,其最终产物是( )
A.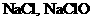 B.
B.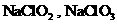
.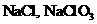 D.
D.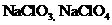
87.下列叙述正确的是 ( )
A.复分解反应不一定不是氧化还原反应
B.只有一种生成物的化学反应不一定是化合反应
.有阳离子存在的物质中一定存在阴离子
D.离子反应一定是复分解反应
86.实验室可由软锰矿(主要成分为Mn2制备Mn4,方法如下:软锰矿与过量固
体H和l3在高温下反应,生成锰酸钾(2Mn4)和l;用水溶解,滤去残渣,
滤液酸化后,2Mn4转变为Mn2和Mn4;滤去Mn2沉淀,浓缩滤液,结晶得
到深紫色的针状Mn4。
请回答:
(1)软锰矿制备2Mn4的化学方程式是 ;
(2)2Mn4制备Mn4的离子方程式是 ;
(3)若用2. g软锰矿(含Mn280%)进行上述实验,计算Mn4的理论产量;
g软锰矿(含Mn280%)进行上述实验,计算Mn4的理论产量;
(4)Mn4能与热的经硫酸酸化的Na224反应生成Mn2+和2,该反应的化学方程
式是 ;
()上述制得的Mn4产品0.16g,恰好与0.33g钝Na224反应完全,计算该
Mn4的纯度。
8.下列叙述中,正确的是 ( )
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
.某元素从化 合态变为游离态时,该元素一定被还原
合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
84.一定条件下硝酸铵受热分解的化学方程式为:NH4N3=2HN3+4N2+9H2,在反应中被氧化与被还原的氮原子数之比为 ( )
A.∶3 B.∶4 .1∶1 D.3∶
83. R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被 还原成0价时表现的氧化性大小符合( )
还原成0价时表现的氧化性大小符合( )
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
82.近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质--碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
+ 2r27 + H24(稀)→ 2+ 24+ r2(4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
81.实验室可由软锰矿(主要成分为Mn2制备Mn4,方法如下:软锰矿与过量固
体H和l3在高温下反应,生成锰酸钾(2Mn4)和l;用水溶解,滤去残渣,
滤液酸化后,2Mn4转变为Mn2和Mn4;滤去Mn2沉淀,浓缩滤液,结晶得
到深紫色的针状Mn4。
请回答:
(1)软锰矿制备2Mn4的化学方程式是 (2分);
(2)2Mn4制备Mn4的离子方程式是 (2分);
(3)若用2.g软锰矿(含Mn280%)进行上述实验,计算Mn4的理论产量;
(4)Mn4能与热的经硫酸酸化的Na224反应生成Mn2+和2,该反应的化学方程
式是
 (2分);
(2分);
()上述制得的Mn4产品0.16g,恰好与0.33g钝Na224反应完全,计算该
Mn4的纯度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com