
题目列表(包括答案和解析)
4.下列各变化中属于原电池反应的是 ( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
3.下列说法中正确的是 ( )
A.摩尔是表示物质质量的单位 B.10g氟化氢含有0.5molHF分子
C.1g氢气的物质的量是1mol D.物质的摩尔质量等于其式量
2.下列说法正确的是(NA表示阿伏加德罗常数) ( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molHe含有的原子数目为2NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数相同
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是 ( )
A.锌 B.汞 C.石墨 D.二氧化锰
21.(11分)有A、B、C三种可溶性正盐,其阴、阳离子各不相同,且阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO 、NO
、NO 、Cl-一五种离子,同时生成一种白沉淀。请回答下列问题:
、Cl-一五种离子,同时生成一种白沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列离子中的一种,该离子是 (填字母)。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C 。
(3)不需要加入任何试剂就能将上述三种正盐溶液区分开来,则鉴别出来的先后顺序为 (填化学式)。
(4)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有Fe3+、SO 、NO
、NO 、K+ 四种离子且物质的量之比依次为l:2:3:4,则A、B、C三种正盐的物质的量之比为
。
、K+ 四种离子且物质的量之比依次为l:2:3:4,则A、B、C三种正盐的物质的量之比为
。
10.(10分)粉煤灰是一种火山灰质材料,来源于煤中的无机组成,从粉煤灰中能够获得Al2O3,已知某火力发电厂的粉煤灰中的化学成分如下表:
|
成分 |
SiO2 |
Al2O3 |
Fe2O3 |
CaO |
CuO |
SO2 |
|
质量分数% |
50.6 |
28.9 |
8.4 |
2.8 |
7.8 |
1.5 |
请回答下列问题:
(1)上述氧化物中能与水反应的是 。
(2)从粉煤灰中提取Al2O3的一种工艺流程如下:
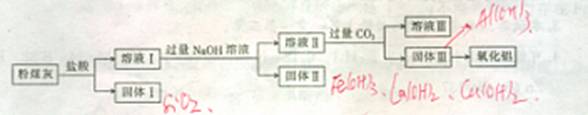
①固体I中含有的主要物质的化学式为 。
②在溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为
(3)氧化铝和焦炭的混合物与氮气在高温下反应,可制得新型非金属材料A1N与一种中学常见气体x。已知每转移3 mol-,就有1.5mol化合物X生成,此反应的化学方程式为 。
19.(9分)SnCl4在催化杂Diels-aider反应、酚甲酰化反直中有重要应用,某化学研究小组欲探究SnCl4的制备。
[参阅资料] SnCl4在常温下是无色液体,沸点为114℃,遇潮湿空气便发生水解反应,Sn的熔点为 231℃。
[实验步骤]
第一步:金属Sn的制备--以锡石SnO2为原料,用过量的焦炭作还原剂,在高温下可制得粗锡。
第二步:SnCl4的制备--用干燥、纯净的C12与熔融的Sn反应制备SnCl4同时放出大量的热。
下图是实验室制备SnCl4的实验装置:

[问题思考]
(1)第一步反应的化学方程式为 。
(2)装置B、C中的药品分别为 。
(3)当反应生成SnCl4时,应熄灭 处的酒精灯,理由是 。
[实验改进]
老师说装置E设计不完整,请你提出修改意见,并说明修改的目的: 。
18.(9分)碳、硅、铝都是常见的还原性单质;
(1)碳、硅、铝对应的袅化物中既能与盐酸反应,又能与NaOH溶液反应的是 。(填化学式)。
(2)工业上制取纯硅涉及以下三个反应:
|
|
|
|
③SiCl4+2H2====Si(纯)+4HCl
其中属于置换反应的有____;反应①、②、③的反应物中有C、H2、Cl2、SiO2,按照某种物质分类标准,它们中有一种物质与其他三种物质明显不同,该物质为 ,写出分类的依据 (只需写出一种分类方法)。
(3)碳、铝均能还原铁的氧化物。为确定混合物(含FeO、Fe2Os)的组成,现进行如下实验:
①取一定质量混合物与足量炭粉共热,只收集到CO气体m mol;
②取与①相同质量的混合物与足量铝进行铝热法炼铁,得到单质铁n mol则混合物中FeO的物质的量分数是 (用m/n表示)。
17.(8分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

提示:NaOH溶液(160g·L-1)是指每升溶液中含溶质160g。
试回答下列问题:
(1)该NaOH溶液的物质的量浓度为____mol.L-1。
(2)吸收塔中ClO2、NaOH与H2O2反应生成NaClO2和O2,该反应中被氧化的物质是 。
(3)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是 。(填字母)。
A.NaCl、Cl2 B.NaCl、NaClO
C.NaClO3、NaClO4 D.NaCl,NaClO3
(4)NaClO3与SO2反应生成ClO2和Na2SO4时,氧化剂与还原剂的物质的量之比为 。
16.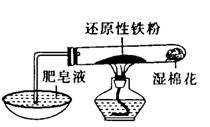 (8分)铁不能与冷、热水反应,但能与水蒸气反应。
(8分)铁不能与冷、热水反应,但能与水蒸气反应。
资料显示,在不同温度下,还原性铁粉与水蒸气反
应的产物不同,温度低于570℃时,主要生成FeO;
高于570℃时,主要生成Fe3O4。右图所示为某还原
性铁粉研究性学习小组设计的还原性铁粉
与水蒸气反应的实验装置图。请回答下列有关问题:
(1)写出800℃时还原性铁粉与水蒸气反应的化学
方程式:
(2)实验中使用肥皂液可以检验Hz的存在,能证明Hz存在的实验现象是?
(3)该小组同学为探究其实验后试管内的固体含有哪些物质.进行了下列实验:
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末X放人试管1中,加入盐酸,微热 |
黑色粉末逐渐溶解,溶液星绿色;有少量气泡产生 |
|
② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是 ;不能确定是否存在.Fe3O4的原因是?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com