
题目列表(包括答案和解析)
18.(2009·山东)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是__________。电池工作时,电子流向__________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________。若电解电路中通过2 mol电子,MnO2的理论产量为__________g。
解析:干电池锌(皮)作负极,炭棒作正极,若电解质溶液中混有Cu2+则会形成Zn-Cu原电池而加快锌的腐蚀,在(3)中阳极:Mn2+-2e-+2H2O===MnO2+4H+电路中通过2 mol e-时,生成MnO21 mol(87g)。
答案:(1)Zn(或锌) 正极
(2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
17.(2009·江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( )
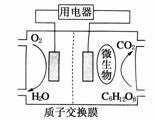
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体L
解析:A选项:温度过高,不利于微生物的生存;C选项中,原电池工作时,电解质溶液中的阳离子(H+)应从负极向正极做定向运动;D选项中,原电池工作的总反应为:C6H12O6+6O2===6CO2+6H2O,所以每消耗1 mol O2,就能生成1 mol CO2气体。
答案:B
16.(2009·郑州)获得“863”计划和中科院“百人计划” 支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720-8721,2006)上,已知电池总反应式为2Al+3I2===2AlI3。下列说法不正确的是 ( )
A.该电池负极的电极反应为:Al-3e-===Al3+
B.电池工作时,溶液中铝离子向正极移动
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多
D.该电池可能是一种可充电的二次电池
解析:A项,根据电池总反应式,推知该原电池中铝作负极,电极反应式为Al-3e-===Al3+;B项,电池工作时,Al3+向正极移动;C项,Li的摩尔质量比Al小,因此Li比等质量Al提供电子的物质的量多;D项,充电时为电解池,在水溶液中Al3+不可能得电子生成Al,因此该电池不是可充电的二次电池。
答案:D
15.(2009·浙江金华一模)现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
解析:根据①可知还原性:M>N,根据③可知还原性:N>E,而P能与冷水直接反应,故P的还原性最强,由此可得还原性:P>M>N>E。
答案:B
14.(2009·广东)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
解析:该电池以NaCl溶液为电解液时,正极反应为O2+2H2O+4e-===4OH-,负极反应为Al-3e-===Al3+,Al3+与OH-进一步反应生成Al(OH)3;以NaOH溶液为电解液时,正极反应为O2+2H2O+4e-===4OH-,负极反应为Al+4OH--3e-===AlO+2H2O,电池工作中溶液pH减小。
答案:A
13.(2009·山东省烟台市高三模块检测)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
答案:C
12.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上产生大量气泡。则四种金属的活动性顺序由强到弱的是 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
[答案] B
11.对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是 ( )
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出1 gH2 ④铜片上析出1 mol H2
A.①③ B.①④
C.②③ D.②④
[答案] A
10.(2009·芜湖模拟)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电,高铁电池的总反应为:
3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是 ( )
A.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO+4H2O
C.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
D.放电时正极附近溶液的碱性增强
解析:由电池的总反应可知放电时:正极反应为FeO+3e-+4H2O===Fe(OH)3+5OH-,负极反应为Zn-2e-+2OH-===Zn(OH)2,此时K2FeO4得电子被还原,A项错误,C、D正确,充电时阳极反应为放电时正极反应的逆过程,B项正确。
答案:A
9.(2009·重庆模拟)有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
|
实验次数 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
桔子 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
甲同学提出的问题,乙同学解释不正确的是 ( )
|
|
甲同学 |
乙同学 |
|
A |
实验6中的负极电极反应式如何写? |
铝为负极:Al-3e-===Al3+ |
|
B |
实验1和实验5电流方向为什么相反? |
1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
|
C |
水果电池的电压与哪些因素有关? |
只跟水果的类型有关 |
|
D |
实验中发光二极管不太亮,如何使它更明亮起来? |
可用铜锌作电极,用菠萝作介质并将多个此电池串联起来 |
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com