
题目列表(包括答案和解析)
18.(10分)(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水蒸气。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是: ____________________________________。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个反应的热化学方程式:_________________________________________________。
(3)家用液化气的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,试写出丁烷燃烧的热化学方程式: _______________________________________________。
丁烷的燃烧热为________kJ·mol-1。已知1 mol液态水汽化时需要吸收44 kJ的热量,则反应:C4H10(g)+O2(g)===4CO2(g)+5H2O(g) 的ΔH=________kJ·mol-1。
解析:(1) SiH4的摩尔质量为32 g·mol-1,故其燃烧热为:(44.6×32) kJ·mol-1=1427.2 kJ·mol-1。(2)产物中含有CO2,则反应物中必有炭的参与,由此即可写出热化学方程式。(3)C4H10的摩尔质量为58 g·mol-1,当丁烷燃烧生成水蒸气时,比其完全燃烧生成液态水减少了液态水汽化时需要吸收的热量。
答案:(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(g)
ΔH=-1427.2 kJ·mol-1
(2)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g)
ΔH=-290 kJ·mol-1
 (3)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)
(3)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)
ΔH=-2900 kJ·mol-1 2900 -2680
17.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) === CH4(g)+HC CH(g)+H2(g);
CH(g)+H2(g);
ΔH1=+156.6 kJ·mol-1
CH3CH===CH2(g) ===
CH4(g)+HC CH(g);
CH(g);
ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) === CH3CH===CH2(g)+H2(g)的ΔH=________kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 _______________;放电时,CO32-移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-)(填“>”、“=”或“<”),原因是____________________________________________ (用离子方程式和必要的文字说明)。
解析:(1)根据盖斯定律,将两反应式相减得到:
C3H8(g) === CH3CH===CH2(g)+H2(g)
ΔH=+124.2 kJ·mol-1。
(2)该燃料电池的电解质是熔融碳酸盐,电池反应方程式是C3H8燃烧的方程式。放电时,阴离子向负极移动。
(3)根据平衡常数K1=,c(H+)=c(HCO3-)=2.5×10-6 mol·L-1,c(H2CO3)=1.5×10-5 mol·L-1,可求出K1=4.2×10-7 mol·L-1。
(4)由NaHCO3溶液的pH>8得HCO3-的水解程度大于电离程度。
答案:(1)124.2 (2)C3H8+5O2===3CO2+4H2O 负 (3)4.2× 10-7 mol·L-1 (4)> HCO3-+H2O CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3- CO32-+H+)、HCO3-+H2O
CO32-+H+)、HCO3-+H2O H2CO3+OH-,HCO3-的水解程度大于电离程度
H2CO3+OH-,HCO3-的水解程度大于电离程度
16.用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
解析:选B。电解过程中的反应为:阳极:4OH--4e-===2H2O+O2↑,阴极:2Cu2++4e-===2Cu。总反应为:2CuSO4+2H2O2H2SO4+2Cu+O2↑。由以上反应可知,溶液中每生成1 mol H2SO4,即减少1 mol CuSO4和1 mol H2O。由此可知,要使溶液恢复至原来状况,应加入CuO,反应为:CuO+H2SO4===CuSO4+H2O。加入Cu(OH)2也能与H2SO4反应,生成CuSO4和H2O,但生成的水量较多,溶液不能恢复至原来状况,反应为:Cu(OH)2+H2SO4===CuSO4+2H2O。
15.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。则以下说法不正确的是( )
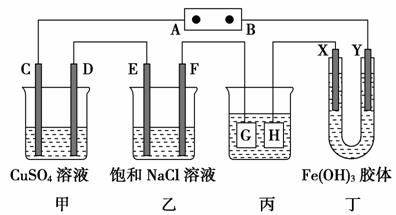
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量比为1∶2∶2∶2
C.欲用丙装置给铜镀银,G应该是Ag,电镀液选用AgNO3溶液
D.装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒带正电荷
解析:选A。乙中F极显碱性,说明该极发生2H++2e-===H2↑,F为阴极,E为阳极,故A为正极,B为负极。在甲、乙装置中的电极产物分别是C-O2,D-Cu,E-Cl2,F-H2,故B项正确。C项中G为阳极,电极材料应为Ag,H作阴极,电极材料为Cu,电解质溶液应为AgNO3溶液,故C项正确。D项X为阳极,Y为阴极,X极附近红褐色变浅,说明Fe(OH)3胶粒移向了Y极,即Fe(OH)3胶粒带正电荷。
14.下列说法正确的是( )
A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B. 25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
解析:选B。中和热是在稀溶液里强酸与强碱发生中和反应生成1 mol水时所释放出的热量,而1 mol H2SO4和1 mol Ba(OH)2完全中和时生成2 mol H2O,A错误;燃烧热指在25 ℃、101 kPa时1 mol该物质完全燃烧生成稳定的化合物时所放出的热量,与实际燃烧的硫的物质的量无关,B正确;C不完全燃烧产生的CO是一种良好的气体燃料,其燃烧反应一定是放热反应,C错误;燃烧热是温度和压强的函数,因为不同温度下测得的反应热是不同的,故未指明温度谈燃烧热无意义,且若碳不完全燃烧所放出的热量也不能称为燃烧热,D错误。
13.相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
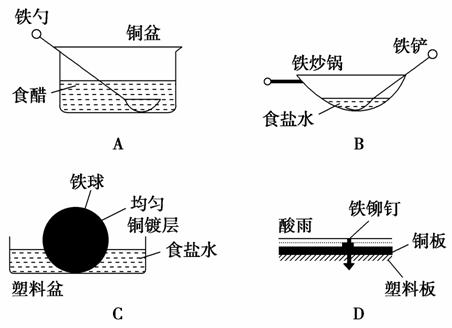
解析:选C。在A中,食醋提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属电极,形成原电池,铁是活泼金属,作负极;在B中,食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁是活泼金属,作负极,碳作正极;在D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负极、正极,形成原电池;在上述三种情况中,都是铁作负极,铁容易被腐蚀;在C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀。
12.在用Zn片、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中H2SO4的物质的量减小
D.电解液的pH保持不变
解析:选C。Zn比Cu活泼,故Zn失电子,做负极,电子从锌片流向铜片,故电流方向应从铜片流向锌片。溶液中H+在铜片附近得电子,生成H2放出,故H2SO4的物质的量减小,电解液的pH增大。
11.电解100 mL含c(H+)=0.30 mol·L-1的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A.0.10 mol·L-1 Ag+ B.0.20 mol·L-1 Zn2+
C.0.20 mol·L-1 Cu2+ D.0.20 mol·L-1 Pb2+
解析:选C。根据金属活动顺序表可知:排在氢以后的金属为Ag和Cu,而Zn和Pb排在H以前,所以Ag+、Cu2+的氧化性比H+大,应优先于H+放电而析出,因为0.01 mol Ag的质量小于0.02 mol Cu的质量,所以C项正确。
10.金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )
A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析:选D。A项,阳极发生氧化反应。B项,阴极只析出Ni,阳极的Ni、Fe、Zn都溶解,所以阳极减少的质量与阴极增加的质量不相等。C项,溶液中还存在大量Ni2+。D项,Cu、Pt不如Ni活泼,在阳极不放电,形成阳极泥。
9.(2009年邯郸模拟)2008年北京奥运会“祥云”奥运火炬所用为环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol
丙烷:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2221.5 kJ/mol
正丁烷:C4H10(g)+6.5O2(g)===4CO2(g)+5H2O(l)
ΔH=-2878.0 kJ/mol
异丁烷:C4H10(g)+6.5O2(g)===4CO2(g)+5H2O(l)
ΔH=-2869.6 kJ/mol
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0 kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
解析:选B。A项,常温下,正丁烷的燃烧热应为2878.0 kJ/mol;B项,丙烷燃烧时丙烷的质量、产生的热量以及消耗的氧气为44 g、2221.5 kJ/mol、5 mol,正丁烷燃烧时正丁烷的质量、产生的热量以及消耗的氧气为58 g、2878.0 kJ/mol、6.5 mol,所以相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多;C项,常温下,CO的燃烧热为283.0 kJ/mol;D项,人类利用的能源可以不通过化学反应获得,如水力发电、风力发电、太阳能等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com