
题目列表(包括答案和解析)
2.在电解质溶液的导电性装置(如图)所示中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A.盐酸逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.硫酸中逐滴加入氢氧化钡溶液
D.醋酸中逐滴加入氨水
1.下列物质中,既能导电又属于强电解质的一组物质是( )
A.石墨、食醋
B.液氨、石灰水
C.熔融MgCl2、熔融NaOH
D.稀硫酸、蔗糖
12.菠菜营养丰富,素有“蔬菜之王”之称,是一种高效的补铁剂。长期以来民间流传有“菠菜不能与豆腐同食”、“菠菜根比菠菜茎叶更有营养”等说法。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁?
②菠菜是否含有草酸类物质?
③菠菜根中铁的含量是否比菠菜茎和叶的高?
该同学通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
Ⅰ.
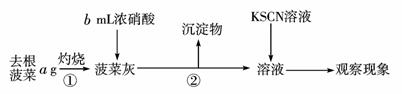
Ⅱ.取菠菜根a g使用相同仪器、试剂,重复Ⅰ中实验,观察实验现象。
Ⅲ.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液。向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象。
请回答以下问题:
(1)操作①中使用的仪器除三脚架、酒精灯、玻璃棒外还需要____________,操作②的名称是____________;
(2)可以说明菠菜根中Fe元素含量要比菠菜茎叶中多的现象是__________;
(3)菠菜中的Fe是+2价还是+3价?____________________;
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰。则X是______________(写化学式),加入试剂X后观察到的现象是____________。
11.(2009年上海卷)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是____________。
(2)已知02 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知____________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式填入下列方框中,并标出电子转移的方向和数目:

 +
+ 

10.(2009年山东)盐酸是应用广泛的酸之一,它具有:①酸性 ②氧化性 ③还原性 ④挥发性。请回答下列问题:
(1)浓盐酸长时间露置在空气中,溶液的质量减轻表现了____________(填序号)。
(2)实验室用稀盐酸和锌粒反应制取氢气表现了____________(填序号),反应的离子方程式为- 。
(3)用盐酸除去铁表面的铁锈表现了____________(填序号),反应的离子方程式为_________________。
(4)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①被还原的元素是____________,还原剂是____________。
②氧化产物是____________,若生成5 mol Cl2,转移的电子总数为____________。
9.“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为;KCN+H2O2+H2O=A+NH3↑
回答下列问题:
(1)生成物A的化学式为____________。
(2)在标准状况下有0448 L氨气生成,则转移的电子数为____________。
(3)反应中被氧化的元素为____________。
(4)H2O2被称为“绿色氧化剂”的理由是- 。
8.(2010年浙江杭州一中)Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是
( )
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有8 mol电子转移
7.(2009年江苏镇江)在下列溶液中,各组离子一定能够大量共存的是
( )
A.含Fe3+的溶液中:K+、H+、Cl-、MnO4-
B.使石蕊试液变红的溶液:Na+、Cl-、SO42-、Fe3+
C.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
D.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
6.下列反应的离子方程式正确的是
( )
A.Fe3O4与稀盐酸反应:
Fe3O4+8H+=Fe2++2Fe3++4H2O
B.将Cu片插入AgNO3溶液中:Cu+Ag+=Cu2++Ag
C.过氧化钠溶于水中:Na2O2+H2O=2Na++2OH-+O2↑
D.实验制取Cl2:MnO2+4H++4Cl- MN2++2Cl2↑+2H2O
MN2++2Cl2↑+2H2O
5.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法正确的是
( )
A.还原性Cr3+>Fe2+>SO2
B.氧化性Cr2O72->SO2>Fe3+
C.Cr2O72-能将Na2SO3氧化成Na2SO4
D.两个反应中Fe2(SO4)3均作还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com