
题目列表(包括答案和解析)
(一)碱金属元素:
1.原子结构 相似性:最外层电子数相同,都为_______个
递变性:从上到下,随着核电核数的增大,电子层数增多
2.
 碱金属化学性质的相似性:
碱金属化学性质的相似性:
4Li + O2 Li2O 2Na + O2 Na2O2
2 Na + 2H2O = 2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑
2R + 2 H2O = 2 ROH + H2 ↑
产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子最外层上都只有 __ 个电子,因此,它们的化学性质相似。
3.碱金属化学性质的递变性:
递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从Li到Cs的金属性逐渐增强。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
4.碱金属物理性质的相似性和递变性:
1)相似性:银白色、硬度小、密度小(轻金属)、熔点低、易导热、电、有展性。
2)递变性(从锂到铯):
①密度逐渐增大(K反常) ②熔点、沸点逐渐降低
3)碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。
递变性:同主族从上到下,随着核电核数的增加,电子层数逐渐_______,原子核对最外层电子的引力逐渐________,原子失去电子的能力________,即金属性逐渐_______。
[练习]
4.关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
5.关于钠和钾元素的比较中,不正确的是( )
A.钾原子失电子比钠原子容易 B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈 D.KOH碱性比NaOH强
6.下列关于碱金属的叙述中正确的是( )
A.碱金属单质与水反应都能生成碱和H2
B.碱金属单质都是质软、熔点低、密度均小于1的轻金属
C.碱金属元素随原子半径增大,原子核吸引最外层电子的能力增强
D.碱金属单质在空气中燃烧都生成过氧化物
3.已知A元素原子的最外层电子数是次外层电子数的3倍,B元素原子的次外层电子数是最外层电子数的2倍,则A、B元素
A.一定是第二周期元素 B.一定是同一主族元素
C.可能是二、三周期元素 D.可以相互化合形成化合物
2.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
A.ⅢB族 B.ⅢA族 C.ⅠB族 D.ⅠA族
周期序数=核外电子层数 主族序数=最外层电子数
原子序数 = 核电荷数 = 质子数 = 核外电子数
 短周期(第1、2、3周期)
短周期(第1、2、3周期)
 周期:7个(共七个横行) 长周期(第4、5、6、7周期)
周期:7个(共七个横行) 长周期(第4、5、6、7周期)
 周期表 主族7个:ⅠA-ⅦA
周期表 主族7个:ⅠA-ⅦA
族:16个(共18个纵行) 副族7个:IB-ⅦB
第Ⅷ族1个(3个纵行)
零族(1个)稀有气体元素
[练习]
1.主族元素的次外层电子数(除氢)
A.一定是8个 B.一定是2个
C.一定是18个 D.是2个、8个或18个
24.(2010·南平模拟)人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积
的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将
此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定
血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓
度:
[配制KMnO4标准溶液]下图是配制50mLKMnO4标准溶液的过程示意图。
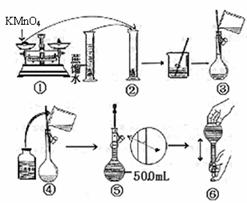
(1)请你观察图示判断其中不正确的操作有(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将____________(填偏大或偏小)
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:
2MnO4―+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O
则式中的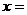 ________________。
________________。
(5)滴定时,根据现象_____________________________,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+离子的浓度为________mg/cm3。
[解析](1)量筒不能用于配制溶液,视线应该与凹液面的最低点相平读数,所以②⑤操作错误;(2)配制50mL一定物质的量浓度KMnO4标准溶液需要50mL的容量瓶;(3)仰视读数时,定容时,所加的水超过刻度线,体积偏大,所以浓度偏小。(4)~(6)血样处理过程中发生反应的离子方程式依次是:①Ca2++C2O42-=CaC2O4↓;②CaC2O4+2H+=Ca2++H2C2O4;③2MnO4―+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O,由此可得如下关系式:5Ca2+-5CaC2O4-5H2C2O4-2MnO4―,所以n(Ca2+)=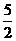 n(MnO4-)=
n(MnO4-)=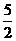 ×0.0120L
×0.0120L
×0.020mol·L-1=6.0×10-4mol,血液样品中Ca2+的浓度=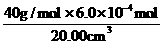 =1.2×10-3g/cm3=1.2mg/cm3。对于反应③根据电荷守恒,2×(-1)+6×(+1)=2×(+x),所以x=2。草酸溶液无色,当反应正好完全进行的时候,多加一滴KMnO4溶液,溶液恰好由无色变为紫红色。
=1.2×10-3g/cm3=1.2mg/cm3。对于反应③根据电荷守恒,2×(-1)+6×(+1)=2×(+x),所以x=2。草酸溶液无色,当反应正好完全进行的时候,多加一滴KMnO4溶液,溶液恰好由无色变为紫红色。
[答案](1)②⑤ (2)容量瓶 (3)偏小
(4)2 (5)溶液由无色变为紫红色 (6)1.2
|

|
23.(2010·石家庄模拟)用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为______mL的容量瓶;
(2)经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的______。
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2-3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是______(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是____________(填“偏高”、“偏低”、“无影响”)。
[解析](1)由于实验室里没有220mL容量瓶,所以必须选用250mL容量瓶,先配制250mL溶液,再从其中取出220mL即可。(2)c(HCl)=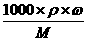 =
=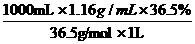 =11.6mol/L。加水稀释前后HCl的物质的量不变,所以11.6mol/L·V(HCl)=250mL×1mol/L,解得V(HCl)=21.6mL,应该选择25mL的量筒量取。(3)配制一定物质的量浓度的溶液基本步骤为:计算→称量或量取→溶解→冷却后转移洗涤→振荡后定容→倒转摇匀,所以正确的顺序是③①④②。(4)用刚刚洗涤洁净的量筒来量取浓盐酸,量取的盐酸被稀释了,其物质的量比实际偏小,所配制溶液的浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则一部分溶质损失,所配制溶液的浓度偏低。
=11.6mol/L。加水稀释前后HCl的物质的量不变,所以11.6mol/L·V(HCl)=250mL×1mol/L,解得V(HCl)=21.6mL,应该选择25mL的量筒量取。(3)配制一定物质的量浓度的溶液基本步骤为:计算→称量或量取→溶解→冷却后转移洗涤→振荡后定容→倒转摇匀,所以正确的顺序是③①④②。(4)用刚刚洗涤洁净的量筒来量取浓盐酸,量取的盐酸被稀释了,其物质的量比实际偏小,所配制溶液的浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则一部分溶质损失,所配制溶液的浓度偏低。
[答案](1)250 (2)21.6 C (3)③①④② (4)偏低;偏低
22.(2010·兴义模拟)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL 0.100mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要_________________________。
(2)需准确称取Na2S2O3固体的质量为_______________g。
(3)另取废水50.00mL,控制适当的酸度加人足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤.过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O2溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
[解析](1)配制0.100mol·L-1的Na2S2O3溶液时,将Na2S2O3固体在烧杯中溶解,将溶液沿玻璃棒转移到250mL容量瓶中,用胶头滴管定容,所以必须使用到这三种玻璃仪器。
(2)m(Na2S2O3)=0.250L×0.100mol·L-1×158g·mol-1=3.95g。
(3)设Ba2+的物质的量为x,则有:
Ba2+~BaCrO2~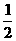 Cr2O72-~
Cr2O72-~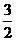 I2~3S2O32-
I2~3S2O32-
1mol 3mol
xmol 36.00×0.100×10-3mol
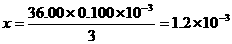 mol
mol
所以c(Ba2+)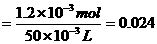 mol·L-1
mol·L-1
[答案](1)胶头滴管 (2)3.95 (3)0.024mol·L-1
21.(2010·唐山模拟)某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。拟选用下列实验装置完成实验:
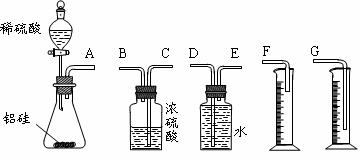
(1)该组同学必须选用的装置的连接顺序是(填接口字母,可不填满。):
A接( )( )接( )( )接( )
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?_______________。
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________ L·moL-1。
[解析]测定气体的摩尔体积,可以测定一定量的金属和酸反应放出的氢气的体积,然后根据化学方程式得到气体的摩尔体积的计算表达式。(1)测定气体的体积可以用排水法测定液体的体积,为了能够保证将液体顺利排出,E为进气口,F为出水口,导气管深入量筒内部,可以防止液体溅出而使测得的气体体积偏小,所以正确的装置的连接顺序是A→E→D→G。(2)金属和酸反应为放热反应,而且随着反应快速进行,锥形瓶内气体越来越多,压强越来越大,所以分液漏斗内的液体不容易流下。(3)测量气体体积时,一定要使气体的温度和压强与外界温度和大气压相同,所以应将实验装置冷却到室温,然后调节量筒中液面与广口瓶中液面相平,以保证气体压强等于外界大气压,读数时注意要平视量筒刻度。(4)反应的铝的质量为m(Al)=(m1-m2)g,气体的体积为V×10-3L,由化学方程式:
2Al+3H2SO4=Al2(SO4)3+3H2↑
54g 3Vm L
(m1-m2)g V×10-3L
得Vm=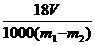 L·moL-1。
L·moL-1。
[答案](1)EDG (2)铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 (3)待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积。
(4)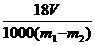
20.(2010·淄博模拟)在t℃时,将ag NH3完全溶解于水,得到VmL溶液。假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述正确的
是( )。
A.溶质的质量分数ω=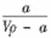 ×100%
×100%
B.溶质的物质的量浓度c=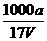 mol/L
mol/L
C.溶液中c(H+)=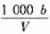 mol/L
mol/L
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
[解析]选B。
19.(2010·沈阳模拟)有一浓度为14%的KOH溶液,加热蒸发掉100g水后,得到浓度为28%的KOH溶液80mL,则浓缩后溶液的物质的量浓度为( )。
A.6mol/L B.6.25mol/L C.5mol/L D.7.25mol/L
[解析]选B。蒸发前后KOH的质量和物质的量都不变,假设原溶液的质量为x,则:x·14%=(x-100g)×28%,解得:x=200g,m(KOH)=200g×14%=28g,n(KOH)=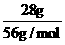 =0.5mol,c(KOH)=
=0.5mol,c(KOH)=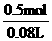 =6.25mol/L。
=6.25mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com