
题目列表(包括答案和解析)
4.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
3.下列说法正确的是 ( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.电解水时为增强导电性可以加入少量的CuCl2 固体
C.粗铜精炼时,与电源正极相连的是纯铜
D.钢铁发生电化腐蚀的正极反应式:Fe-2e- == Fe2+
2.下列说法不正确的是 ( )
A.加强工业用水系统的环保改造,提高水的重复利用率
B.加强城市生活污水处理,坚持达标排放
C.电池对水体会造成污染,对废旧电池要回收处理。
D.用石墨作阳极,铁作阴极,电解含有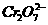 的酸性工业废水,从而生成Cr(OH)3、Fe(OH)3 沉淀,除Cr的污染。
的酸性工业废水,从而生成Cr(OH)3、Fe(OH)3 沉淀,除Cr的污染。
1.由于气体可以混合从而省去了昂贵的燃料隔离膜,其
工作原理如图所示。下列说法正确的是 ( )
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
14.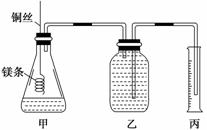 (14分)(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
(14分)(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
13.(12分)生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混
合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:
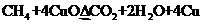 。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产
。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产
生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为 。
12.(12分)在25°C、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体,使其完全燃烧,干燥
后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)= L;V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)= 。
(3)若剩余气体的体积为a L,则a的取值范围是 。
11. (12分)
(1)2 mol O3和3 mol O2的质量之比 ,分子数之比 ,同温同压的密度之比 ,含氧原子
数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则
相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A的分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
10.将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8 L(标准状况下),则这三种金属的物质的量之和可能为 ( )
A.0.250 mol B.0.125 mol C.0.100 mol D.0.080 mol
9.NA代表阿伏加德罗常数。下列有关叙述正确的是 ( )
A.标准状况下,2.24 L H2O含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N-H键数目为0.2 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com