
题目列表(包括答案和解析)
3、(2010·济南模拟)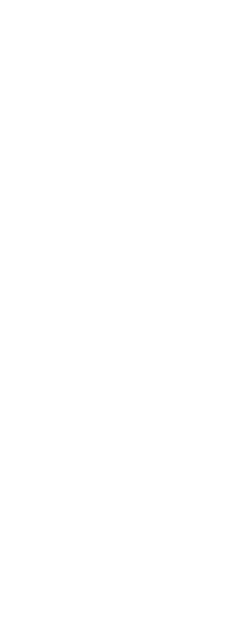 将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 (
)
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 (
)
A.3 mol·L HCl溶液 B.4 mol·LHNO3溶液
C.5 mol·L NaOH溶液 D.18.4 mol·L H2SO4溶液
[解析]选A。本题考查金属的性质,较易题。B项中硝酸和D项中浓硫酸与金属反应不产生氢气;C项中NaOH溶液只与铝反应而不与镁反应,而A项中HCl溶液与镁和铝均能反应,A项正确。
2、(2010·郑州模拟)Al、Mg混合物与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体质量比原固体增加了4.8g,则该混合物的物质的量可能为 ( )
A.0.04mol B.0.03mol C.0.06mol D.0.05mol
[解析]选A。由题意知所得的固体为Al2(SO4)3、MgSO4,SO42-的物质的量为4.8/96=0.05mol,若固体全部是MgSO4则固体的物质的量为0.05mol,若固体全部是Al2(SO4)3则固体的物质的量为0.0333mol。故混合物的物质的量在0.0333mol和0.05mol之间,选A。
1、(2010·深圳模拟) 2007年4月,广、深两地连发化学品爆炸事故。广州化工厂仓库着火是在搬运桶装亚氯酸钠的过程中引起的;深圳化工厂的爆炸事件是由于仓库渗水,金属镁粉接触水后起火,并随后引燃废料房内的废油引发的。据此,下列说法正确的是 ( )
A.亚氯酸钠属于易燃易爆的物质,搬运时应轻装轻卸,切勿猛烈撞击
B.上述两起火灾都可以用水或沙土扑灭
C.金属镁粉活性很强,其还原性比镁条强
D.由于镁粉与石油不能直接反应,故可以放在一起保存
[解析]选A。金属镁着火不能用水来灭,因为反应可生成氢气,B项错误;镁粉与镁条的成分相同,所以还原性相同,但镁粉与物质反应时由于接触面积大而剧烈,C项错误;保存镁时不能与易燃物放在一起,D项错误。
15、(2010·南开中学模拟)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 ) 。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04 . 5H20) 。经查阅资料得知 ,
在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:
① 试剂I为 ,试剂II为 (填字母)。
② 固体X的化学式为 。
③ 操作I为 。
[解析](1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色。
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应,故此种说法不正确。
(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu。
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数。
(5)根据表格可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,在利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质,故第一步氧化剂应是H2O2,再加入Cu2(OH)2CO3,调节pH,使溶液中的Fe3+生成沉淀除去。
[答案] (1)溶液变为血红色
(2)不合理 Cu能将Fe3+还原为Fe2+
(3)Fe2O3和Cu2O的混合物 Fe2O3+6H+ = 2Fe3++3H2O Cu2O+2H+ = Cu + Cu2+ + H2O
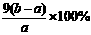 2 Fe3+ + Cu = 2 Fe2+ + Cu2+
2 Fe3+ + Cu = 2 Fe2+ + Cu2+
(4)
(5)① B D ② Fe(OH)3 ③加热蒸发
|

|
14、(2010·许昌模拟)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如下图(部分反应产物已略去).

请回答下列问题:
(1)A的化学式为______________.
(2)A溶液与Na2O2反应的总化学方程式为______________________________.
(3)E的稀溶液与F溶液反应的离子方程式为_____________________________.
(4)电解100mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为5.6mL,则电解后溶液的pH为__________.(假设溶液体积不变)
(5)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体C.则滤液中溶质的物质的量浓度为__________.(假设溶液体积不变)
[答案](1)Cu(NO3)2
(2)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑
(3)3Fe2++NO3-+4H+==3Fe3++NO↑+2H2O
(4)2 (5)0.2mol/L
13、(2010·曲靖模拟)下图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:B、C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色。
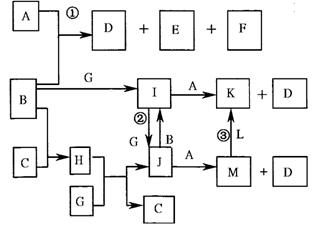
请回答下列问题:
(l)D的电子式:____________________________;
(2)反应①的离子方程式是____________________________;
(3)反应②的离子方程式是____________________________;
(4)反应③的化学方程式是___________________________________;
(5)保存J溶液时还需加入___________________________________。
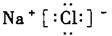 (6)实验室由J制备少量M 的方法:用胶头滴管吸取A溶液,将滴管尖端插入盛有新制J溶液试管底部,慢慢挤出A 溶液即可,观察到的现象为:_______________;这样操作的理由是__________________
(6)实验室由J制备少量M 的方法:用胶头滴管吸取A溶液,将滴管尖端插入盛有新制J溶液试管底部,慢慢挤出A 溶液即可,观察到的现象为:_______________;这样操作的理由是__________________
[答案] ⑴
(2) Cl2 +2OH- ===ClO- +C1-+H2O
(3) Fe +2Fe3+ ===3Fe2+
(4) 4Fe(OH)2 +O2 +2H2O=== 4Fe(OH)3↓
(5) 稀HC1 铁屑
(6) 开始析出一种白色的絮状沉淀,然后迅速变成灰绿色,最后变成红褐色; 避免生成的Fe(OH)2沉淀接触O2
12、(2010·上海徐汇区模拟)若氢气还原氧化铜的反应进行得不完全,便得到 Cu、Cu2O、CuO的固体混合物。某化学兴趣小组同学为测定上述固体的组成进行如下操作: 取一定质量的均匀固体混合物A,将其分成两等份,取其中一份用足量氢气还原,测得反应后的固体质量减少3.20g ,另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L 。
请根据以上操作计算:
(1)A中,n(Cu)+n(Cu2O)=_______ ;
(2) A中,n(CuO)的取值范围是____________ ;
(3) 试计算所用硝酸的物质的量浓度。
[解析](1)根据化合价升降相等可得每份[n(Cu)+n(Cu2O)]х2= n(NO) х3=0.3mol则n(Cu)+n(Cu2O)= 0.15mol ① ,混合物A中n(Cu)+n(Cu2O)= 0.3mol
(2)固体减少质量为混合物中氧元素的质量[n(Cu2O)+ n(CuO) ] х16=3.20则n(Cu2O)+ n(CuO) =0.2mol②
若每份中n(Cu)= 0.15mol,则n(Cu2O)= 0,由质量差可得n(CuO) =0.2mol,混合物A中n(CuO) =0.4mol,
若每份中n(Cu)= 0,则n(Cu2O)= 0.15mol,由质量差可得n(CuO) =0.05mol,混合物A中n(CuO) =0.1mol;
(3)①+②可得n(Cu)+2n(Cu2O)+ n (CuO)=0.35mol,则n(HNO3)=0.35х2+0.1=0.8mol ,C(HNO3)=1.6mol/L
[答案](1)0.3mol (2)0.1-0.4mol
(3)C(HNO3)=1.6mol/L
11、(2010·天津大港区模拟)下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
[解析]选C。A中引入了水蒸气;B中最后得到的不是BaCO3;D项中Cu与稀硝酸发生反应,形成溶液,不符题意。
10、(多选)(2010·中山模拟)下列有关实验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中不一定含有CO32-
[解析]选AD。 A选项利用了铝与氢氧化钠反应铁不反应的原理除去铝;B项中陶瓷的成分是硅酸盐类化合物与熔融的氢氧化钠发生反应,所以淘汰;C项无法制得e(OH)3胶体,应选用饱和的FeCl3溶液滴到热水中的方法;D项中SO32-的现象和CO32-是一样的,所以正确。
9、(2010·天津大港区模拟)用铜来制备等质量的Cu(NO3)2,下列方法中最合理的方案是 ( )
A.Cu 与浓HNO3反应 B.Cu 与稀HNO3反应
C.CuO与稀HNO3反应 D.Cu(OH)2与稀HNO3反应
[解析]选C。A、B中会有NO、 NO2等有毒气体生成污染环境;D项中Cu(OH)2的制备浪费了更多的原料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com