
题目列表(包括答案和解析)
2.(2010年泰州质检)一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)=H2(g)+I2(g)。若c(HI)由01 mol·-1L降到0.07 mol·-1L时,需要15 s,那么c(HI)由0.07 mol·-1L时降到0.05 mol·-1L时,所需反应的时间为( )
A.等于5 s
B.等于10 s
C.大于10 s
D.小于10 s
1.(2009年福建五校)常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )
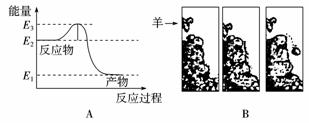
A.E2
B.E2-E1
C.E3-E2
D.E3
22.(8分)目前人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以能使Na+自由通过而导电的β-Al2O3陶瓷作固体电解质,反应式为:
2Na+xS Na2Sx。
Na2Sx。
⑴放电时正负极的电极反应式:
正极反应式:__________________________;负极反应式:______________________。 ⑵用该电池作电源进行电解含有0.2molCuSO4和0.2molNaCl的混合溶液500ml时,若此电池工作一段时间后消耗23gNa。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2L,溶液的pH为:________。
21.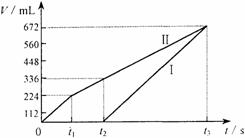 (8分)常温下电解200mL一定浓度的NaCl与
(8分)常温下电解200mL一定浓度的NaCl与
CuSO4混合溶液,理论上两极所得气体的体积
随时间变化的关系如下图所示(气体体积已换
算成标准状况下的体积),根据图中信息回答
下列问题。(电解前后溶液的体积变化忽略不记)
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
20.(8分)化学在能源开发与利用中起着十分关键的作用。
⑴蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。你认为可燃冰晶体的类别及理由: _ 。
⑵设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
⑶能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决能源紧缺问题的两点建议 。
19.(6分)将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
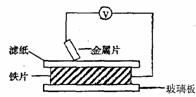
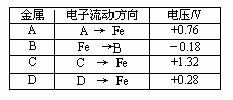
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1)A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(用字母表示),此时对应的电极反应式为:负极____________________________________
正极___________________________________________
18.(9分)下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物或生成物已略去)。已知:A是海水中的重要资源;C、D、F是单质,其中C、D在常温常压下是气体;反应②是化工生产中的重要反应,生成物E是具有消毒、漂白杀菌作用。J、K均为不溶于水的物质,其中J为红褐色。
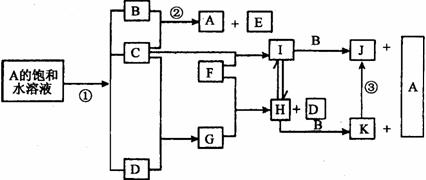
请按要求填空:
(1)反应①的离子方程式(请注明反应条件)_________________________________。
(2)B的电子式____________________;E的化学式___________________________。
(3)③的化学方程式____________________________________。
(4)目前各类燃料电池中能量转化效率最高的是“陶瓷电池”,D与氧构成的燃料电池,通过氧离子在固体氧化物电解质中穿过而导电。写出“陶瓷电池”电极反应式:
负极:_______________________________________________
正极:_________________________________________________
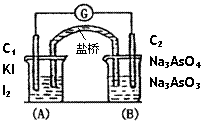
17.(8分)已知反应AsO43-+2I-+2H+
 AsO33-+I2+H2O
AsO33-+I2+H2O
是可逆反应。设计如图装置(盐桥中的阴、阳离子
可以自由移动,盐桥在原电池中不参与反应,只起
导体作用),进行下述操作:(Ⅰ)向(B)烧杯中
逐滴加入浓盐酸,发现微安培表指针偏转;(Ⅱ)
若改往(B)烧杯中滴加40%NaOH溶液,发现
微安培表指针向前述相反方向偏转。
①两次操作过程中指针偏转方向为什么会相反?试用电极反应和化学平衡移动的原理解释此现象。
__________________________________________________________________________。
②(Ⅰ)操作过程中C1棒上发生的电极反应为 。
③(Ⅱ)操作过程中C2棒上发生的电极反应为__________________ _。
16.(8分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
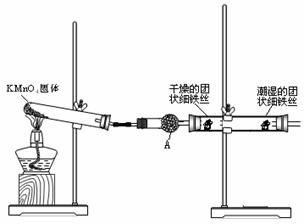
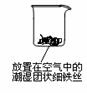
首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___________。
能表示其原理的反应方程式为__________________________________________
(2)仪器A的名称为______________,其中装的药品可以是____________________,其作用是_________________________________________________________
 (3)由实验可知,该类铁生锈的条件为_______________________________________。决定铁生锈快慢的一个重要因素是__________________________________
(3)由实验可知,该类铁生锈的条件为_______________________________________。决定铁生锈快慢的一个重要因素是__________________________________
15.如图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时,该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是
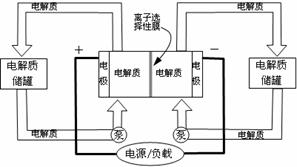
A.电池充电时,阳极电极反应式为:3Br--2e-=Br3-
B.电池放电时,负极电极反应方程式为:2S22-+2e-=S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2 Na2S2+ NaBr3
D.在充电过程中钠离子从右边通过离子选择性膜流向左边
第Ⅱ卷(非选择题 共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com