
题目列表(包括答案和解析)
1.引入官能团:
①引入-X的方法:烯、炔的加成,烷、苯及其同系物、醇的取代
②引入-OH的方法:烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇和CO2
③引入C=C的方法:醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O
8.有机反应现象归类
①能发生银镜反应或新制的Cu(OH)2悬浊液反应的:醛类、甲酸、甲酸某酯、葡萄糖、麦芽糖
②与钠反应产生H2的:醇、酚、羧酸
③与NaOH等强碱反应的:酚、羧酸、酯、卤代烃
④与NaHCO3溶液反应产生气体的有机物:羧酸
⑤能氧化成醛或羧酸的醇必有-CH2OH结构,能氧化成酮的醇必有-CHOH结构
⑥能使溴水因反应而褪色的:烯烃、炔烃、苯酚、醛及含醛基的物质
⑦能使酸性KMnO4溶液褪色的:烯烃、炔烃、苯的同系物、苯酚、醛及含醛基的物质如甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等
⑧能发生显色反应的:苯酚与FeCl3、蛋白质与浓硝酸
⑨能发生水解反应的有机物:卤代烃、酯、糖或蛋白质
⑩含氢量最高的有机物;一定质量的有机物燃烧,消耗量最大的是:CH4
⑾完全燃烧时生成等物质的量的CO2和H2O的是:环烷烃、饱和一元醛、酸、酯(通式符号CnH2nOx的物质,X=0,1,2,……)
7、重要的有机反应规律: ① 双键的加成和加聚:双键致意断裂,加上其它原子或原子团或断开键相互连成链。 ② 醇或卤代烃的消去反应:总是消去与羟基或卤原子所在碳原子相邻的碳原子上的氢原子上,若没有相邻的碳原子(如CH3OH)或相邻的碳原子上没有氢原子[如(CH3)3CCH2OH]的醇不能发生反应。 ③ 醇的催化反应:和羟基相连的碳原子上若有二个或三个氢原子,被氧化成醛;若有一个氢原子被氧化成酮;若没有氢原子,一般不会被氧化。 ④ 酯的生成和水解及肽键的生成和水解: R1-CO-OH+18O-R2 =R1-CO-18O-R2+H2O; R1-CH(NH2)-CO-18OH+H-NH-CH(R2)COOH=R1-CH(NH2)-CO-NH-CH(R2)COOH+H2(18)O(虚线为断键处) ⑤ 有机物成环反应:a二元醇脱水,b羟基的分子内或分子间的酯化,c氨基的脱水。(d二元羟基酸脱水)
5、有机反应条件 ①NaOH醇溶液并加热:卤代烃的消去反应。 ②NaOH水溶液并加热:卤代烃或酯的水解反应。 ③浓H2SO4并加热:醇脱水生成醚或不饱化合物;醇与酸的酯化反应;纤维素水解。 ④稀酸并加热:酯或淀粉的水解反应。 ⑤催化剂并有氧气:醇氧化为醛或醛氧化为酸。 ⑥催化剂并有氢气:碳碳双键 、碳碳叁键、苯环或醛基的加成反应。 ⑦催化剂并有X2:苯环上的H原子直接被取代;光照并有X2:X2与烷或苯环侧链烃基上的H原子发生的取代反应。 6.有特殊性的有机物归纳:
① 醇羟基:跟钠发生置换反应、可能脱水成烯、可能氧化成醛或酮、酯化反应
② 酚羟基:弱酸性、易被氧气氧化成粉红色物质、显色反应、与浓溴水发生取代反应
③ 醛基:可被还原或加成(与H2反应生成醇)、可被氧化(银镜反应、与新制Cu(OH)2悬浊液、能使酸性KMnO4溶液、溴水褪色)
④ 羧基:具有酸的通性、能发生酯化反应
⑤ 碳碳双键和碳碳叁键:能使溴水、酸性KMnO4溶液褪色、能发生加成和加聚反应
⑥ 酯基:能发生水解反应
3、结构 ①具有4原子共线的可能含碳碳叁键。 ②具有4原子共面的可能含醛基。 ③具有6原子共面的可能含碳碳双键。 ④具有12原子共面的应含有苯环。 4.不饱和度的推算:一个双键或一个环,不饱和度均为1;一个叁键不饱和度为2;一个苯环,可看作是一个环加三个叁键,不饱和度为4;不饱和度为1,与相同碳原子数的有机物相比,少两个H,不饱和度为2,少四个H,依此类推。
2、 通式:
①符合CnH2n+2为烷烃,符合CnH2n为烯烃,符合CnH2n-2为炔烃,符合CnH2n-6为苯的同系物,符合CnH2n+2O为醇或醚,符合CnH2nO为醛或酮,符合CnH2nO2为一元饱和脂肪酸或其与一元饱和醇生成的酯。
②C:H=1:1的有机物有:乙炔、苯、苯酚、苯乙烯、立方烷
③C:H=1:2的有机物有烯烃、环烷烃、饱和一元醛、饱和一元酸、普通酯、葡萄糖等
④C:H=1:4的有机物有CH4、CH3OH、CO(NH2)2
1、物理性质
(1)、状态
固态--饱和高级脂肪酸、脂肪、TNT、萘、蒽、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下)、针状的TNT;
气态--C4以下烷、烯、炔、甲醛、一氯甲烷
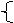 液态-- 油状--硝基苯、溴乙烷、乙酸乙酯、油酸
液态-- 油状--硝基苯、溴乙烷、乙酸乙酯、油酸
粘稠状--石油、乙二醇、丙三醇
(2)、气味
无味--甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味);
稍有气味--乙烯
特殊气味--苯及同系物、萘、石油、苯酚
刺激性--甲醛、甲酸、乙酸、乙醛
甜味--乙二醇、丙三醇、蔗糖、葡萄糖、麦芽糖
香味--乙醇、低级酯
苦杏仁味--硝基苯
(3)、颜色
白色--葡萄糖、多糖
淡黄色--TNT、不纯的硝基苯
黑色或深棕色--石油
(4)、密度
比水轻的--苯及其同系物、一氯代烃、乙醇、乙醛、低级酯、汽油
比水重的--硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃、二硫化碳
(5)、挥发性
乙醇、乙酸、乙醛
(6)、升华性
萘、蒽
(7)、水溶性
不溶:高级脂肪酸、酯、硝基苯、溴苯、甲烷、乙烯、苯及同系物、萘、蒽、石油、卤代烃、TNT
微溶:苯酚、乙炔、苯甲酸
易溶:甲醛、乙酸、乙二醇、苯磺酸
与水混溶:乙醇、苯酚(70℃以上)、乙醛、甲酸、丙三醇
22.二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。 试回答下列问题:
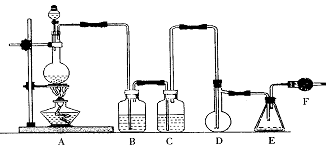
(1)装置A中发生反应的化学方程式为 。
(2)装置C应盛放的药品是 .
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)F装置中干燥管内所盛物质是 ,作用是 。
20.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
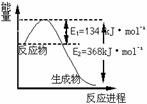
(1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行
如下化学反应:N2(g)+3H2(g) 2NH3(g)⊿H<0,
2NH3(g)⊿H<0,
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
其化学平衡常数K与温度t的关系如右表:
请完成下列问题;
①试比较K1、K2的大小,K1________________K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数的值为_____。
N2(g)+3H2(g)的化学平衡常数的值为_____。
当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的υ(N2)(正)____υ(N2)(逆)(填写“>”、“=”或“<”=)
21有一种广泛用于汽车,家电产品上的高分子涂料是按下图合成的。①W为链烃,相对分子质量42;②5.6克M完全燃烧,气态产物依次通入浓硫酸和碱石灰中,产物完全被吸收,浓硫酸增重3.6克,碱石灰增重13.2克,相同条件下,M蒸气密度为氦气的14倍;③M、A均可发生银镜反应,M、N中碳原子数相等;④A烃基饱和且烃基上的一氯取代有三种
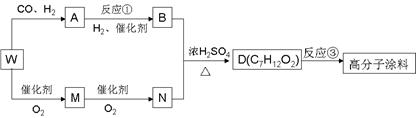
已知:在一定条件下,CH2=CH2+CO+H2→CH3CH2CHO
(1)写出下列物质的结构简式A______________,M______________
(2)写出N+B→D化学反应方程式:_____________________________________
(3)反应③的反应类型___________________
(4)D可发生下列哪些反应__________
①加成反应②取代反应③消去反应④还原反应⑤氧化反应_
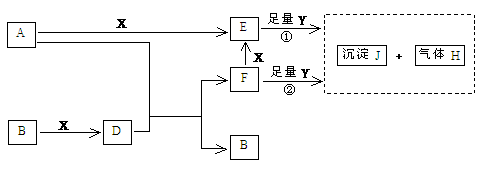
19、下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。
已知:A是常见金属单质,HBX为三种气体单质,D溶于水是一种常见的强酸,一个D分子
含有18个电子,Y是一种淡黄色固体粉末。
 。
。
(1)写出B化学式: _________
(2)写出D的电子式_________ ,液态D能否导电_________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上由于电化学腐蚀,每年损耗A年产量的10%。请写出A发生电化学腐蚀负极的电极反应式:___________________________;
(4)写出①中所涉及的反应的化学方程式为:
__________________________________,______________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com