
题目列表(包括答案和解析)
10.在相同条件下进行Mg与HCl、CH3COOH反应的对照实验,相关数据如下:
|
|
Mg的质量 |
酸量 |
开始时反应速率 |
产生H2总量 |
|
Ⅰ |
0.24 g |
HCl0.2 mol·-1L100 mL |
v1 |
n1 |
|
Ⅱ |
0.24 g |
CH3COOH 0.2 mol·-1L100 mL |
v2 |
N2 |
(1)试比较有关量的大小:
v1____________v2,n1____________N2(填“>”、“=”或“<”)。
(2)现欲改变条件,使实验Ⅰ中的v1降低,但不改变n1的值,试写出两种可行的方法。
方法①____________ 。
方法②____________ 。
9.在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应。使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ·mo-1L表示。请观察下图,回答问题。
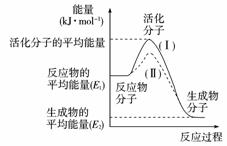
(1)图中所示反应是____________(填“吸热”或“放热”)反应ΔH是____________(用E1、E2表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);ΔH=-241.8 kJ·mo-1L,该反应的活化能为167.2 kJ·mo-1L,则其逆反应的活化能为____________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________ 。
8.(2009年盐城质检)反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积增大
7.某温度下,反应2N2O5=4NO2+O2。开始时c(N2O5)=0.0408 mol·-1L,经1 min后测得c(N2O5)=0.030 mol·-1L,则该反应速率为( )
A.v(N2O5)=1.08×10-4 mol·-1L·s-1
B.v(N2O5)=1.8×10-4 mol·(L·s)-1
C.v(O2)=9.0×10-5 mol·(L·s)-1
D.2v(NO2)=v(N2O5)
6.反应A+B→C的反应速率方程式为:v=k·c(A)·c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1 mol·-1L时,反应速率在数值上等于速率常数。下列说法正确的是( )
A.只增大c(A)时,v也增大
B.只增大c(A)时,v值不变
C.只升高温度时,k值不变
D.只升高温度时,k值变小
5.(2010年枣庄模拟)可逆反应mA(g)+nB(g)=pC(g)+gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧乙图阴影部分面积更大
以上正确的为( )
A.②④⑤⑦
B.①④⑥⑧
C.②③⑤⑧
D.①③⑥⑦
4.(2009年浙江台州)在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )
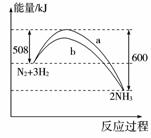
A.该反应的热化学方程式为:N2+3H2=2NH3;ΔH=-92 kJ
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放出的热量增多
D.加入催化剂可增大正反应速率,降低逆反应速率
3.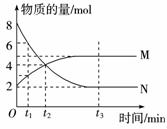 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图所示,下列表述中正确的是( )
A.反应的化学方程式为:2M=N
B.t2时,正逆反应速率相等
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
2.(2010年泰州质检)一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)=H2(g)+I2(g)。若c(HI)由01 mol·-1L降到0.07 mol·-1L时,需要15 s,那么c(HI)由0.07 mol·-1L时降到0.05 mol·-1L时,所需反应的时间为( )
A.等于5 s
B.等于10 s
C.大于10 s
D.小于10 s
1.(2009年福建五校)常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )
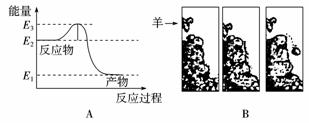
A.E2
B.E2-E1
C.E3-E2
D.E3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com