
题目列表(包括答案和解析)
12.(2010年枣庄模拟)二氧化硫是常用的化工原料,也是大气污染物。硫酸生产中,SO2催化氧化生成SO3:2SO2+O2  2SO3。
2SO3。
(1)若反应在恒温、恒容下进行,判断该反应达到平衡状态的标志是____________(填序号)。
A.SO2和SO3的浓度相等
B.容器内压强保持不变
C.SO2和SO3生成速度相
D.SO2百分含量保持不变
(2)SO2的平衡转化率(a)与温度(T)和压强(p)关系如下图所示。
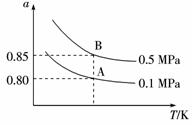 ①图象中平衡常数K(A)____________K(B)(填“大于”或“等于”或“小于”),反应的ΔH____________0(填“大于”或“等于”或“小于”)。
①图象中平衡常数K(A)____________K(B)(填“大于”或“等于”或“小于”),反应的ΔH____________0(填“大于”或“等于”或“小于”)。
②图中虚线的温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,达平衡后,体系的总压强为0.10 MPa,反应的平衡常数是____________。
(3)用NaOH溶液吸收SO2气体可生成正盐或酸式盐。在25 ℃下,某浓度的NaHSO23溶液的pH=6;则溶液中c(H2SO3)____________c(SO32-)(填“大于”或“等于”或“小于”);若忽略水的电离及H2SO3的二级电离,已知H2SO3[FYKN]H++HSO32-常数K1=1.23×10-2,则0.1 mol·-1L H2SO3的H+的物质的量浓度c(H+)=____________
11.(2010年重庆模拟)碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物。某课外兴趣活动小组的同学进行了以下的实验活动。
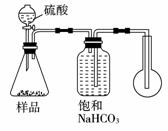
(1)甲同学用如右图所示的装置进行工业纯碱样品(含少量氯化钠等不与酸反应的杂质)中碳酸钠质量分数的测定。广口瓶中用碳酸氢钠饱和溶液而不用水。用饱和碳酸氢钠溶液的优点是____________,请解释原因____________ 。
(2)乙同学给10 ℃的NaHCO3饱和溶液加热,测得该溶液的pH发生了如下的变化。请回答下列问题:
|
温度/℃ |
10 |
20 |
30 |
加热煮沸后,冷却到时50 ℃ |
|
PH |
8.3 |
8.4 |
8.5 |
8.8 |
①乙同学测定溶液的pH可选用____________(填序号)。
A.常用pH试纸 B.pH计(酸度计)
C.酚酞试液 D.甲基橙试液
②乙同学认为产生上述现象的原因有两种可能。预测之一是:加热时NaHCO3受热分解生成了Na2CO3;预测二是:____________ 。
③查阅资料发现:NaHCO3的分解温度为150 ℃,由此判断,乙同学对第一种情况的预测是____________(填“正确”或“不正确”)。请你设计实验验证预测二是否正确____________ 。
(3)丙同学认为:在饱和的NaHCO3溶液中,Na+、H+、HCO3-、CO32-、OH-的离子浓度存在大小关系和等量关系。
①以上5种离子浓度由大到小的顺序是____________ 。
②[Na]++[H+]=____________ 。
10.已知:CH3COOH=CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为K=[CH3COO-]·[H+]/[CH3COOH];CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为K h=[CH3COOH]·[OH-]/[CH3COO-](式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数KW的关系是__________;由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·-1L的CH3COOH溶液中[H+]=____________(不为0)。
(3)现用某未知浓度(设为c)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②____________ ;
③用____________(填一种实验方法)测定溶液浓度c。
(4)若测得25 ℃时CH3COOH的电离平衡常数K=1.8×10-5,则该温度下0.18 mol·-1L的CH3COONa溶液的pH=____________。
9.(1)常温下,0.2 mol·-1LHCl溶液与0.2 mol·-1L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:①混合溶液中由水电离出的[H+]____________HCl溶液中由水电离出的[H+]。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
[Cl-]-[M+]=____________ mol·-1L;
[H+]-[MOH]=____________ mol·-1L。
(2)常温下若将0.2 mol·-1L MOH溶液与0.2 mol·-1L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度____________MCl的水解程度。(填“>”、“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH____________。(填“>7”或“< 7”或“无法确定”)
8.(2009年黄山质检)20 ℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY<HX
B.结合H+的能力Y->CO32->X->HCO3-
C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
D.HX和HY的酸性相同但比H2CO3弱
7.(2009年潍坊质检)下列说法正确的是( )
A.相同温度下,1 mol·-1L醋酸溶液与0.5 mol·-1L醋酸溶液中,c(H+)之比是2∶1
B.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-)
C.pH=3的盐酸和醋酸加水使溶液体积分别扩大100倍,pH仍相同
D.0.1 mol·-1L NH4Cl溶液中,c(NH3·H2O)+c(NH4+)=c(Cl-)
6.(2009年天津卷)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度c(CO32-)均增大
5.(2009年湖州质检)有四位学生分别设计实验来证明某种盐的水解是吸热的。其中正确的是( )
A.甲学生:将硝酸铵晶体溶于水,水温下降
B.乙学生:在盐酸中加入相同温度的氨水,混合液温度下降
C.丙学生:在醋酸钠溶液中滴入酚酞试液,加热后血红色加深
D.丁学生:在醋酸钠溶液中加入醋酸钠晶体,溶液温度下降
4.下列关于盐类水解的叙述正确的是( )
A.溶液呈中性的盐一定是强酸和强碱生成的盐
B.含有弱酸根盐的水溶液一定显碱性
C.盐溶液的酸碱性主要取决于盐是否可溶
D.Na2SO4溶液呈中性,是因为它是强酸硫酸和强碱氢氧化钠生成的盐
3.(2010年枣庄模拟)已知HClO和H2CO3的电离常数分别为HClO:Ka=3×10-8,H2CO3:
Ka1=4.3×10-7、Ka2=4.3×10-11,下列有关内容不正确的是( )
A.向新制氯水中加入足量CaCO3固体过滤可得HClO和CaCl2的混合溶液
B.同物质的量浓度的NaHCO3和NaClO中,存在[HClO]+[ClO-]=[HCO3-]+[H2CO3]+[CO32-]
C.在含有上述两种酸的溶液中,一定能大量存在K+、Ba2+、I-、NH4+
D.同物质的量浓度的NaHCO3和NaClO混合溶液中,[HCO3-]>[ClO-]>[OH-]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com