
题目列表(包括答案和解析)
6.(2010年黄冈质检)将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,
即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入CH4的电极为正极;
②正极的电极反应是O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式是CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式是CH4+10OH-=CO32-+7H2O+8e-;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
5.(2009年江苏卷)以葡萄糖为燃料的微生物
燃料电池结构示意图如右图所示。关于该电池的叙述正确的是( )
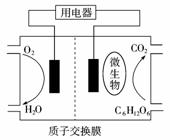
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O2-4e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/6 L
4.X、Y、Z、M、N代表五种金属,有以下化学反应:①水溶液中:X+Y2+=X2++Y ②Z+2H2O(冷)=Z(OH)2+H2↑ ③M、N为电极与N
盐溶液组成原电池,发生的电极反应为:M→M2++2e- ④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化这五种金属的活动性由弱到强的顺序是( )
A.M<N<Y<X<Z__________________
B.N<M<X<Y<Z
C.N<M<Y<X<Z
D.X<Z<N<M<Y
3.在如右图所示的装置中,a为金属(在金属活动性顺序表中排在H前),b为碳棒,关于此装置的各种叙述不正确的是( )
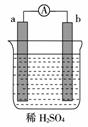
A.碳棒上有气体放出,
溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
2.以下现象与电化学理论无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易生铜锈
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快
D.银质奖牌久置后表面变暗
1.科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如下图所示。下列说法错误的是( )
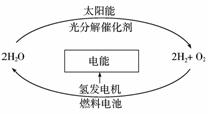
A.在氢能的利用过程中,H2O可循环使用
B.氢气、氧气和稀硫酸构成的燃料电池中,正极的电极反应为:O2+4e-+2H2O=4OH-
C.该法制氢的关键是寻找光分解催化剂
D.利用光电转化可将太阳能转化为电能用于电解水而获得氢气
12.已知A、B、C、D是中学化学中常见的四种不同多核粒子,它们之间存在如下关系
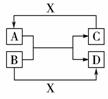
(1)如果A、B、C、D均是10电子的粒子,且X为OH-,请写出:A的结构式____________,D的电子式____________。(2)如果A和C是18电子的粒子,B和D是10电子的
粒子,且X为H+,请写出:①A与B在溶液中反应的离子方程式____________ 。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):____________>____________。
(3)已知肼(H2N-NH2)和甲胺(H3C-NH2)都是含18个电子的分子,分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):____________ ____________ 。
11.(2009年全国卷Ⅰ)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的化学式是____________;
(2)Q的具有相同化合价且可以相互转变的氧化物是-__________________ ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是____________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点
从高到低排列次序是(填化学式)____________,其原因是____________ 。
②电子总数相同的氢化物的化学式是____________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和
该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是____________ 。
10.已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出四种元素的名称:
A____________,B____________,
D____________,E____________。
(2)用电子式表示离子化合物A2B的形成过程:____________ 。
(3)写出C的原子结构示意图____________ 。
(4)写出下列物质的电子式:
D元素形成的单质____________ ;
E与B形成的化合物____________ ;
A、B、E形成的化合物____________ ;
D与E形成的共价化合物____________ 。
9.据周期表知识回答下列问题:(1)PH3分子与NH3分子的构型关系____________(填“相似”或“不相似”),P-H键____________(填“有”或“无”)极性,PH3分子____________(填“是”或“不是”)极性分子。
(2)NH3与PH3相比,热稳定性____________更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是( )
A.键的极性:N-H比P-H强
B.分子的极性:NH3比PH3强
C.相对分子质量:PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力(氢键)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com