
题目列表(包括答案和解析)
21.(10分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)在25℃下,将amol·L-1的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+),则溶液显 性(填“酸…‘碱”或“中”);用含a的代数式表示醋酸的电离常数K a= 。
20.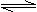 (14分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(14分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(1)该反应进行到 时达到平衡,用AB表示的平均反应速率为: (分数表示)。
(2)图中对应的a的数值是 ,该反应的化学平衡常数K= (保留分数),温度升高K值 (填“增大”、“减少”或“不变”)
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在下图中画出4min-5min的AB浓度的变化线。

(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为amol,bmol、cmol,要使达平衡时各物质的体积分数不变,则a、b、c应满足的关系是 (用含a、b、c的代数式表示)。
19.(7分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水的结构式 。
(2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
18.如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuS04浓溶液。(该过程中不考虑两球浮力的变化)下列说法正确的是 ( )
 A.若杠杆由绝缘体材料制成,一段时间后,
A.若杠杆由绝缘体材料制成,一段时间后,
杠杆一定B端高A端低
B.若杠杆由导体材料制成,一段时间后,
杠杆一定B端高A端低
C.若杠杆由导体材料制成,一段时间后,
杠杆一定A端高B端低
D.无论杠杆由绝缘体材料还是由导体材料制成,
-段时间后,杠杆_定A端高B端低
第Ⅱ卷(非选择题。共54分)
17.已知R为ⅡA族元素,L为ⅢA族元素.它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是: ( )
A.n-m+1 B.n-m+10 C.n=mq-11 D.n=m+25
16.将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CQ体积(V)的关系如图,图中AB段表示的先后离子方程式是 ( )
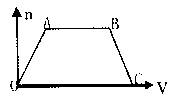 ①CO2+OH-=HCO3-
①CO2+OH-=HCO3-
②CO2+2OH-=CO32-+H2O
③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
A.②⑤ B.⑤④ C④② D.④①
15.难挥发的二硫化钽(TaS2)可采取如图所示加热装置提纯。将不纯的粉末装入石英管的一端,抽真空后引入适量的碘并封管。置于加热炉中,发生如下反应:
 TaS2(s)+2I2(g) Tal4(g)+S2(g)
TaS2(s)+2I2(g) Tal4(g)+S2(g)
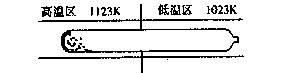
下列说法正确的是 ( )
A.在不同温度区域,TaI4的量保持不变
B.提纯过程中,I2的作用是将TaS2从高温区转移到低温区
C.该化学反应的平衡常数与I2浓度二次幂成正比
D.提纯过程中,I2的量不断减少,故需不断补充
14.下列叙述错误的是 ( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
13. 在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是 ( )
在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是 ( )
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)容积不变的密闭容器中混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A、B、C的分子数目之比为1:3:2。
A.(2)(5) B.(1)(3) C.(2)(7) D.(5)(6)
12.关于下列图示的说法中正确的是 ( )

 A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应
A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可一次而又科学准确的完成比较Cl2、Br2、I2单质氧化性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com