
题目列表(包括答案和解析)
2、(2010·湖南师大附中模拟)能实现下列物质间直接转化的元素是 ( )

A.硅 B.硫 C.氮 D.铁
[解析]选B。硫和氧气反应生成二氧化硫,二氧化硫和水反应生成亚硫酸,再和碱反应生成盐,B项正确;硅、氮和铁的单质和氧气反应生成的氧化物均不能溶于水,ACD项错误。
1、(2010·荆门模拟)下列有关氮族元素和氧族元素比较的叙述中,不正确的是 ( )
A.都有多种化合价
B.都由非金属元素和金属元素组成
C.同周期元素的非金属性:氧族>氮族
D.非金属元素的氧化物的水化物均为强酸(氧除外)
[解析]选D。非金属元素的氧化物的水化物可能为弱酸,如HNO2等。
16.(2010·天津和平区模拟)下图所示的框图中,A-I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
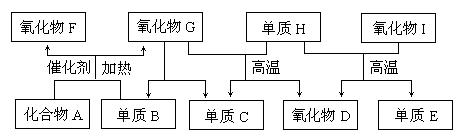
(1)化合物A的化学式是 ,氧化物G的电子式是 。
(2)组成单质E的元素在元素周期表中的位置是 ;单质H和单质E以及氧化物I 均能形成 (填“分子”、“原子”或“离子”)晶体,其中单质E的熔点 (填“高于”、“低于”或“等于”)氧化物I的熔点。
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变
化忽略不计),发生反应的化学方程式为 ,所得溶液的PH= 。此时再向溶液
中通入2.24L化合物A,完全反应后所得溶液的PH (填“>7”、“<7”或“=7”),用离子方程式
表示其原因: 。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为
[答案]
(1)NH3 
(2)第三周期IVA族 ;原子;低于(各1分)
(3)4NO+3O2+2H2O=4HNO3
;1;<7;NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(4)H2+2OH--2e-=2H2O
|

|
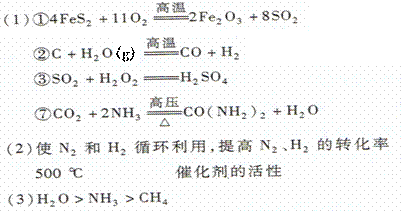
15.(2010·曲靖模拟)A~O等十五种物质之间的转化关系如下图所示。A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液在甲型HlNl 流感的防治中常用作消毒液,D在常温下是无色液体且与X的组成元素相同。F为常见的红棕色防锈油漆颜料的主要成分,O是含氮量最高的常见氮肥,且反应⑦中L与M 的物质的量之比为l︰2,A、E、J、N 中含有同一种元素。

回答下列问题:
⑴写反应的化学方程式①___________________;②___________________;③ __________________;⑦________________________________。
⑵ 步骤⑥的目的和作用________________(1分),设备I中的反应温度是____________(l分),这主要是由________________所决定的(l分)。
⑶组成B、C、I三种单质的非金属元素的气态氢化物的沸点由高到低的顺序是:(用化学式填写) _______________________________________
[答案]
14.(2010·厦门模拟)下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质。
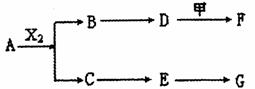
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素。则:
(1)X在周期表中的位置是 ,R、X、T的原子半径从小到大的顺序为
(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显 性,其原因用离子方程式表示为 ;
(3)A和X2反应的化学方程式为 ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移l mol电子时,生成的气体在标准状况下的总体积为 L。
[答案]
(1)第二周期VIA族;O N Na
|

 NH3·H2O+H+
NH3·H2O+H+
|
(4)1:1010(或10-10,10-10:1)
(5)14
13.(2010·天津和平区模拟)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
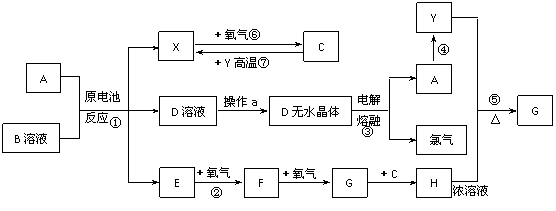

请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为
[答案]
 (1)2Mg+CO2 ==== 2MgO+C (2)将D溶液在HCl气流中蒸干
(1)2Mg+CO2 ==== 2MgO+C (2)将D溶液在HCl气流中蒸干
(3)②4NH3+5O2 ==== 4NO+6H2O

(4)⑤C+4HNO3(浓)====CO2↑+4NO2↑+2H2O
(5)2NH4++2e- ==== 2NH3↑+H2↑
12.(2010·烟台模拟)下列说法不正确的是 ( )
A.当镀锡铁制品的镀层破损后,镀锡铁比镀锌铁更耐腐蚀,镀层能对铁制品起电化学保护作用
B.离子化合物中可以不含金属元素
C.12C和14C互为同位素,而C60与C70互为同素异形体
D.若硝酸与锌反应还原的产物为N2O,被还原硝酸与未被还原硝酸的物质的量之比为1:4
[解析]选A。镀锡铁制品的镀层破损后,形成原电池,铁比锡活泼,铁做负极失电子易被氧化;镀锌铁制品的镀层破损后,形成原电池,锌比铁活泼,铁做正极,受到保护,因此A选项错误;铵盐属于离子化合物不含金属元素,B选项正确;12C和14C互为同位素,而C60与C70互为同素异形体,C选项正确;假设生成1mol的N2O,xmol锌参与反应,由得失电子相等:1×2×(5-1)=2x x=4 mol 生成硝酸锌的物质的量为4 mol,n(被还原硝酸):n(未被还原硝酸)=1×2:4×2=1:4,D选项正确。
11.(2010·台州模拟) 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为( )
A.①>② B.①<② C.①=② D.不能确定

[解析]选C。假设两个容器的状况为标准状况,①中物质的量浓度计算公式为c=(VL÷22.4 L·mol-1)
÷VL=1/22.4 mol·L-1 ②中物质的量浓度计算公式为c=(2/3×V/22.4)mol÷2/3L=1/22.4 mol·L-1 因此C选项正确。
10.(2010·济南模拟)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
[解析]选B。稀硝酸恰好使混合物完全溶解,加入KSCN溶液,无红色出现,说明铁元素在溶液中以Fe(NO3)2形式存在,根据氮元素守恒可以求出n[Fe(NO3)2]=[0.15L×4 mol·L-1-2.24L÷22.4L·mol-1]
÷2=0.25mol,再由铁元素守恒,可以知用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为0.25mol
9.(2010·台州模拟)1.28g Cu完全溶于一定量的浓HNO3中,生成的气体刚好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( )
A.0.16g B.0.02mol C.0.32g D.0.224g
[解析]选C。铜失去的电子给了硝酸,然后硝酸被还原为氮氧化物,氮氧化物与氧气反应,氮氧化物又把电子给了氧气,相当于铜直接把电子给了氧气;由得失电子相等可以计算,n(失电子)=n(得电子),n(Cu)×2=n(O2)×4,(1.28÷64)×2= n(O2)×4, n(O2)=0.01mol,m(O2)=0.01mol×32g/mol=0.32g,因此C选项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com