
题目列表(包括答案和解析)
1.(2009年广州)三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:
4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是
( )
A.NF3中的原子最外层均达8电子
B.NF3的还原性比NH3强
C.NF3的氧化性比F2强
D.每生成1 mol NF3转移6 mol电子
12.(2009年衡水模拟)为了探究铜与浓硫酸的反应,某研究性学习小组做了如下实验:
①在放有铜片的圆底烧瓶中加入10 mL浓硫酸,加热煮沸10 min(如上图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5 mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3 mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到:
|
a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质; b.CuS和Cu2S都能溶于热的浓盐酸; c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。 |
回答下列问题:
(1)第②步操作要注意的问题是____________ ;对比①②两步操作中的现象,你能得到的结论是____________ 。
(2)第③步操作中出现的沉淀是____________ ,请解释出现这一现象的原因____________ 。
(3)写出④步涉及的离子方程式____________ 。
(4)综合分析铜与浓硫酸的反应,生成的不溶物是____________。
11.试设计一个方案,在用廉价的原料和每种原料只用一次的条件下,分三步从含有Fe3+、Cu2+、Cl-和NO3-的废液中,把Fe3+转化为绿矾回收;把Cu2+转化为Cu回收。
各步反应加入的原料依次是____________ 。
各步反应的离子方程式是:
(1)____________ ;
(2)____________ ;
(3)____________ 。
10.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:
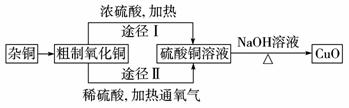
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是____________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:____________
____________ 。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是____________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
9.(2009年广东卷)已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验,探究该混合金属粉末中铁、铜元素的存在。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol·-1L硫酸、2 mol·-1L硝酸、2 mol·-1L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设
假设1 该混合金属粉末中除铝外还含有____________元素;
假设2 该混合金属粉末中除铝外还含有____________元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素。
(2)设计实验方案
基于假设3,设计出实验方案。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
编号 |
实验操作 |
预期现象与结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
8.(2009年豫南模拟)在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化,根据上述现象,确定下面结论正确的是( )
A.不溶物一定是Cu
B.不溶物一定含铜,但不一定含铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,一定不含Cu2+
7.下列叙述正确的是( )
A.碳纤维增强复合材料可用于人体组织中韧带的制作
B.氮化硅陶瓷是新型无机非金属材料
C.银、铜、铁都是有色金属材料
D.碳化硅陶瓷具有压电效应
6.现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·-1L的硫酸溶液50 mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6 a g
B.(a-1.6) g
C.(a-3.2) g
D.1.6 g
5.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是( )
A.将两种样品分别溶于硝酸,通过所产生的气体区别
B.将两种样品分别溶于硝酸,通过溶液的颜色区别
C.取两种同质量的样品分别高温灼烧,通过残留固体的质量区别
D.取两种同质量的样品分别高温灼烧,通过残留固体的颜色区别
4.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体和 蓝色溶液 |
无色气体 |
无色气体和 蓝色溶液 |
红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu
B.Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com