
题目列表(包括答案和解析)
2、(2010·南京模拟)在500℃,恒容的密闭容器中合成氨,起始充入氮气和氢气共a mol,平衡时容器内压强为起始时的75%;若起始充入氮气、氢气和氨气的混合气体共a mol,测得平衡时压强仍为起始时的75%,则两次平衡体系中氨气的百分含量的关系是( )
A.前者 > 后者 B.前者 < 后者 C.两者相等 D.无法确定
[解析]选B。起始充入氮气、氢气和氨气的混合气体共a mol,相当于充入氮气、氢气的物质的量的和多于a mol,合成氨反应正向气体化学计量数减少,而两种情况平衡时压强相同,所以,后者相当于平衡正向移动,氨气的百分含量后者大。
1、(2010·济南模拟)在一恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
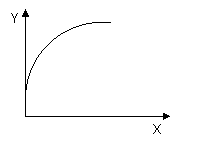
2A(g)+B(g)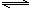 2C(g);△H<0。当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )
2C(g);△H<0。当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )
|
|
X |
Y |
|
A |
温度 |
C的体积分数 |
|
B |
充入稀有气体 |
A的物质的量 |
|
C |
再加入A |
B的转化率 |
|
D |
再加入C |
A的百分含量 |
[解析]选C。A项,该反应是放热反应,温度升高时化学平衡逆向移动,C的体积分数下降,与图不符合;B项,恒容密闭容器中充入稀有气体,平衡不移动,A的物质的量不变,不符合;C项,再加入A,平衡正向移动,B的转化率增大,符合;D项,再加入C,相当于压强增大,平衡正向移动,A的百分含量减少。
19、(2010·哈尔滨模拟)A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:___________________。
(2)Cm-、E(m-1)-的还原性强弱为___________>___________,能证明其还原性强弱的离子方程式为_________________________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_________________________________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为___________________。
(5)在B、C、E单质中,符合下列转化关系的是___________________。
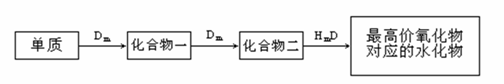
[解析]根据题意,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应,所以B为Al元素,又因为A、B所形成的单核离子具有相同的电子层结构,所以A为Na元素;根据B与E在同一周期,在该周期中,E的原子半径最小,所以E为Cl元素;根据Cm-、E(m-1)-具有相同的电子层结构,所以C为S元素;根据热稳定性:HmD>HmC,所以D为O元素。
[答案](1)H: O :H
(2)S2->Cl- Cl2+S2-=2Cl-+S↓
(3)Al(OH)3 + OH- = AlO2- +2H2O
(4)c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
(5)S
|

|
18、(2010·南阳模拟)以酚酞试剂为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:
|
|
待测液 |
消耗标准盐酸(0.1mol/L)的体积 |
|
① |
20.00mLNaOH溶液 |
V1 mL |
|
② |
20.00mLNaOH溶液+10.00mL水 |
V2 mL |
|
③ |
敞口隔夜放置的20.00mLNaOH溶液 |
V3 mL |
该新制的NaOH溶液的浓度合理的是( )
A.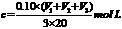 B.
B. 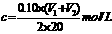 C.
C. 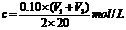 D.
D. 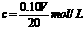
[解析]选A。向20.00mLNaOH溶液加入10.00mL水,再用盐酸滴定,对消耗盐酸的体积无影响。敞口隔夜放置的20.00mLNaOH溶液会吸收空气中的CO2,但以酚酞试剂为指示剂,用盐酸来滴定时 ,最终产物仍然是NaCl,对消耗盐酸的体积无影响。所以合理的是A。
17、(2010·杭州模拟)下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后pH=5
B.在相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍
C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定等于正盐的pH
D.碳酸钠溶液在室温时的pH一定大于60℃时的pH
[解析]选B。A项,pH=3的酸溶液稀释100倍后,若为强酸,则pH=5,若为弱酸pH<5。B项,pH=3的溶液,c (H+)=10-3mol/L,pH=5的溶液c (H+)=10-5,前者氢离子浓度是后者的100倍。C项酸式盐的pH一定小于正盐的pH。D项,温度升高能促进水解,同浓度的碳酸钠溶液的pH,60℃时大于室温时。
16、(2010·南京模拟)常温下将c1 mol/L V1 mL的氨水滴加到c2 mol/L V2 mL的盐酸中,下列结论正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)
C.若混合溶液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合溶液的pH<7,则一定有c1<c2
[解析]选A。A项,若混合溶液的pH=7,则氨水稍过量,c1V1>c2V2;B项,若V1=V2,c1=c2则氨
水与盐酸恰好完全反应,混合液中溶质为NH4Cl, c(Cl-)>c(NH4+);C项,若混合溶液的pH=7,由
电荷守恒知,c(NH4+)=c(Cl-);D项,混合溶液的pH<7,溶质可能是NH4Cl或NH4Cl和HCl,可能
c1=c2或 c1<c2。
15、(2010·厦门模拟)用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),下列有关实验的说法正确的是( )
A.向混有BaCO3沉淀的NaOH溶液中滴入盐酸,不会影响NaOH含量的测定
B.滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则不会影响计算结果
C.若用甲基橙作指示剂,则测定结果偏小
D.可以不用将Na2CO3完全变成BaCO3沉淀,直接滴加标准盐酸,至不再有气泡产生
[解析]选A。A项,酚酞作指示剂,滴定终点显弱碱性,盐酸不会与BaCO3反应,不会影响NaOH含量的测定;B项若滴定管中滴定液一直下降到活塞处,则无法读取数据;C项,若用甲基橙作指示剂,滴定终点显酸性,部分盐酸与BaCO3反应,则测定结果偏大
14、(2010·巢湖模拟)莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液比较不正确的是( )
A.c (SO42-) > c (NH4+)>c (Fe2+)>c (H+)>c (OH-)
B.c (SO42-) = c (NH4+)>c (Fe2+)>c (H+)>c (OH-)
C.2c (SO42-)+ c (OH-) = c (NH4+) + 2c (Fe2+)+ c (H+)
D.c(H+) = c(OH-) + c(NH3· H2O) + 2c( Fe(OH)2 )
[解析]选B。A项,NH4+、 Fe2+水解显酸性,c (SO42-) > c (NH4+),A项正确,B项错误;C项符合电荷守恒;D项符合质子守恒。
13、(2010·济南模拟)已知某溶液中只存在OH-、Cl-、NH4+、H+四种离子,下列说法不正确的是( )
A.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
B.若溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2O
C.若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl
D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl
[解析]选D。A项,若溶液中c(NH4+)=c(Cl-),由电荷守恒知c(OH-)=c(H+),则该溶液一定显中性。B项,溶液呈碱性,溶质只能是NH4Cl和NH3·H2O;C项,溶液呈酸性,溶质可能含有NH4Cl或可能含有NH4Cl和HCl;但若溶质是大量的NH4Cl和少量的HCl,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),D项错误。
12、(2010·广州模拟)将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )
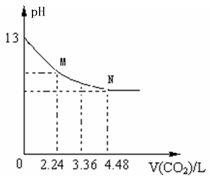
A.NaOH溶液的物质的量浓度为0.1mol/L
B.NaOH溶液的体积为2L
C.M点粒子浓度的大小关系满足c(HCO3-)>c(CO32-)
D.M、N点对应的纵坐标均大于7
[解析]选C。A项,NaOH溶液的pH为13,c(OH-)为0.1mol/L;B项,4.48L CO2物质的量为0.2mol,0.2mol CO2可与NaOH恰好完全反应生成NaHCO3 ,所以NaOH溶液的体积为0.2mol÷ 0.1mol/L﹦2L。C项,M点对应 CO2物质的量为0.1mol,0.1 mol CO2可与NaOH恰好完全反应生成Na2CO3,溶液中粒子浓度的大小关系c(CO32-)>c(HCO3-);D项,M、N点对应的溶液中的溶质分别为 Na2CO3 、NaHCO3,两者水解都显碱性,pH大于7。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com