
题目列表(包括答案和解析)
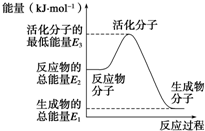 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1| A、反应②中的能量变化如图所示,则△H2=E1-E3 | B、H2的燃烧热为241.8 kJ?mol-1 | C、由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | D、氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ?mol-1 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3
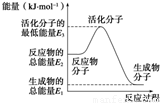
B.H2的燃烧热为241.8 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
已知:N2(g)+3H2(g) ===2NH3(g) ΔH=-92.4 kJ·mol-1
下列说法正确的是
A.反应中的能量变化如图所示,则ΔH=E1-E3
B.若加入催化剂,将改变反应历程,从而改变ΔH
C.温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.若保持温度和容器体积不变,充入氦气,则压强增大,化学反应速率加快

| 27 |
| 16 |
| 27 |
| 16 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com