
题目列表(包括答案和解析)
9. 下列反应的离子方程式正确的是
A. 澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+ =CaCO3↓+H2O
=CaCO3↓+H2O
B. 铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:
Al3++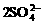 +2Ba2++4OH-=
+2Ba2++4OH-=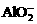 +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
C. H2O2溶液中滴加酸性KMnO4溶液:
2 +5H2O2+6H+=2Mn2++5O2↑+8H2O
+5H2O2+6H+=2Mn2++5O2↑+8H2O
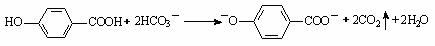
D. 尼泊金酸(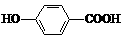 )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
8. 天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、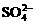 、Br-、
、Br-、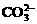 、
、 等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

下列说法错误的是
A. 天然海水pH≈8的原因是由于海水中的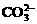 、
、 水解
水解
B. “氧化”是利用氧气将H2SO3、 、
、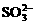 等氧化生成
等氧化生成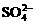
C. “反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D. “排放”出来的海水中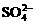 的物质的量浓度与进入吸收塔的天然海水相同
的物质的量浓度与进入吸收塔的天然海水相同
不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7. X、Y、Z三种主族元素,X+和Y-两种离子具有相同的电子层结构,Z原子核内质子数比Y原子核内质子数少9个,Y-在一定条件下可被氧化生成YZ3-离子。下列说法正确的是
A. 离子半径X+>Y- B. X、Y、Z均属于短周期元素
C. 化合物XYZ的溶液具有漂白性 D. Y属于第ⅤA族元素
6. 下列实验现象的解释正确的是
|
|
实验现象 |
高·考¥资%源~网解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
淀粉能与Cl2发生显色反应 |
|
B |
浓硝酸在光照条件下变黄 |
浓硝酸见光分解,生成NO2溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
一定是由于该溶液中含有SO42- |
|
D |
铜片放入冷的浓硫酸中,无明显变化 |
铜在冷的浓硫酸中发生钝化 |
5. 已知阿伏加德罗常数的值为NA,下列说法正确的是
A. 1 mol CH3+(甲基碳正离子)含有的电子数目为9NA
B. 7.2g C5H12中含有的C-C键的数目为0.5 NA
C. 14 g N2和CO的混合气体含有的分子数目为0.5 NA
D. 标准状况下2.24L甲苯含有的碳原子数目为0.7 NA
4. 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:
3NF3+5H2O=2NO+HNO3+9HF
下列有关说法正确的是
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子物质的量之比为2∶1
C. 若反应中生成0.2mol HNO3,则反应共转移0.2mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
3. 常温下,在pH=1的水溶液中能大量共存的离子组是
A. Na+、Mg2+、SO42-、Cl- B. Al3+、NH4+、CH3COO-、Br-
C. K+、Fe2+、SO42-、NO3- D. Na+、Ba2+、I-、ClO-
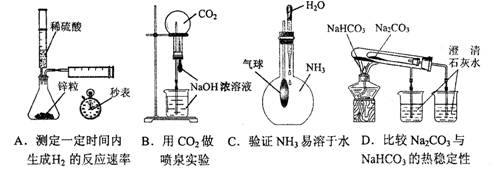
2. 下列实验不能达到目的的是
1. 2008年诺贝尔化学奖授予钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白(一种蛋白质,简称GFP)方面做出的杰出贡献。下列有关GFP的说法错误的是
A. 属于高分子化合物 B. 遇到CuSO4溶液会发生盐析
C. 水解后可得到多种氨基酸 D. 可用于蛋白质反应机理的研究
23.(2010·宜宾模拟)某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、
CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
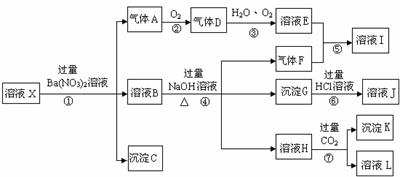
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:_____________________________;不能肯定的是:_________________。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:___________。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的化学式为:_______________,沉淀G的化学式为:_____________,沉淀K的化学式为:____________,实验中,可以观察到反应②的现象是:________________。
(3)写出步骤①所有发生反应的离子方程式_________________、__________________。
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是:______________________。
[解析]强酸性溶液中含有H+,则不含SiO32-、CO32-;加入Ba(NO3)2溶液后生成的沉淀一定是BaSO4,则溶液中含有SO42-,不含Ba2+;气体A能够和氧气反应,所以A为NO,D为NO2,D到E的反应为:4NO2+O2+2H2O 4HNO3,说明该溶液中含有还原性离子,即Fe2+,则原溶液中一定没有NO3-。溶液B能够和NaOH溶液反应生成气体,则该气体一定是NH3,原溶液中一定含有NH4+。符合转化关系:“B
4HNO3,说明该溶液中含有还原性离子,即Fe2+,则原溶液中一定没有NO3-。溶液B能够和NaOH溶液反应生成气体,则该气体一定是NH3,原溶液中一定含有NH4+。符合转化关系:“B H
H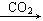 沉淀K”的K为Al(OH)3,则溶液中含有Al3+。
沉淀K”的K为Al(OH)3,则溶液中含有Al3+。
[答案](1)SO42-、Al3+、Fe2+、NH4+ Fe3+ ⑤
(2)NH3 Fe(OH)3 Al(OH)3 气体由无色变成红棕色
(3)Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(4)4∶2∶1
|

|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com