
题目列表(包括答案和解析)
8.下列说法中正确的是 ( )
A.任何原子及其离子,都是核外电子层数等于该元素在周期表中的周期数
B.在元素周期表中,从ⅢB族到ⅡA族的10个纵列中,所有的元素都是金属元素
C.所有稀有气体元素的原子的最外层电子数都是8
D.凡是同种元素的同位素,其各项物理性质、化学性质都相同
答案:B
7.已知X、Y、Z 3种主族元素在元素周期表中的相对位置如图所示,设X的原子序数为a,则下列说法中不正确的是 ( )
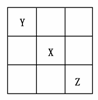
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-19
C.Z的原子序数可能为a+33
D.X、Y、Z一定都是短周期元素
答案:D
6.(2008·广东高考)下列有关原子结构和元素周期律的表述正确的是 ( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③
C.②④ D.③④
答案:C
5.下列关于元素周期表的叙述,不正确的是 ( )
A.共有7个周期,16个族
B.形成化合物种类最多的元素在第2周期
C.ⅡA族的右边是ⅢB族,ⅡA族的左边是ⅡB族
D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n
解析:在HnROm中R元素的化合价为+(2m-n),则其气态氢化物中R元素的化合价应为-(8-2m+n),因此,其气态氢化物的化学式应为H8-2m+nR或RH8-2m+n。
答案:D
4.(2009·上海师大附中模拟)据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号应位于周期表中的 ( )
A.第六周期ⅣA族 B.第七周期ⅥA族
C.第七周期Ⅷ族 D.第八周期ⅥA族
答案:B
3.随着卤素原子半径的增大,下列递变规律正确的是 ( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质氧化性逐渐增强
答案:B
2.(2009·芜湖一中高三一模)全国科学技术名词审定委员2007年3月21日公布:111号元素(符号为Rg)的中文名称为“钅仑”(读音为伦)。下列说法正确的是 ( )
A.111号元素是第6周期ⅠA族的金属元素
B.111号元素属于过渡元素
C.111号元素为非金属元素
D.111号元素质量数为111
答案:B
1.简单原子的原子结构可用下图形象地表示
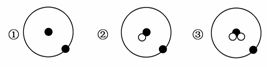
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是
( )
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
A.a、f B.b、c
C.d、e D.e、f
答案:A
20.(2009·福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
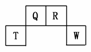
(1)T的原子结构示意图为__________________________________________________。
(2)元素的非金属性(原子的得电子能力)为:Q________(填“强于”或“弱于”)W。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____________________________________________。
(4)原子序数比R多1的元素的一种氢化物,能分解为它的另一种氢化物,此分解反应的化学方程式是
________________________________________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________________________________________________。
(6)在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的ΔH=________(注:题中所设单质均为最稳定单质)
解析:由信息可知,T为第3周期ⅢA族元素,即为Al: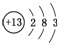 ,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
Al(s)+O2(g)===Al2O3(s);ΔH=-b kJ/mol,……②
则反应4Al(s)+3CO2(g)===3C(s)+2Al2O3(s)为ΔH=②×4-①×3=(3a-4b)kJ/mol。
答案:(1)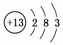 (2)弱于
(2)弱于
(3)S+2H2SO4(浓)3SO2↑+2H2O
(4)2H2O22H2O+O2↑
(5)NaNO2
(6)(3a-4b) kJ·mol-1
19.(2009·天津)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
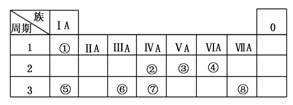
(1)④⑤⑥的原子半径由大到小的顺序是____________________________________。
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是
________________________________________________________________________。
(3)①④⑤⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
________________________________________________________________________。
(4)由表中两种元素的原子按1?1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为________________________________________,
N→⑥的单质的化学方程式为_______________________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
________________________________________________________________________。
解析:据元素的位置可知,①-⑧元素依次为H、C、N、O、Na、Al、Si、Cl,再对号入座,其中(5)由框图可确定N为Al2O3,Z为Al(OH)3。M应为NH4Cl,则X、Y为AlCl3、NH3·H2O,为使NH4Cl中由NH4Cl电离出的c(NH)=c(Cl-)可加入NH3·H2O(Y)至溶液pH等于7。
答案:(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3
(3)Na+[∶····‖H]-(或Na+[∶····∶····∶]-)
(4)a、b (5)Al3++3NH3·H2O===Al(OH)3↓+3NH
2Al2O3(熔融)电解冰晶石4Al+3O2↑ 溶液的pH等于7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com