
题目列表(包括答案和解析)
7、(2010·北京丰台区模拟)下列说法正确的是( )
A.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
B.Na和Cs属于第IA族元素,Cs失电子能力比Na强
C.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
D.镁条在空气中燃烧生成的氧化物是MgO,钠在空气中燃烧生成的氧化物是Na2O
[解析]选B。A项,Fe与水蒸气反应生成Fe3O 4 ,B项,Cs的电子层数比Na多,更易失电子。C项,Na2CO3受热不分解;D项,钠在空气中燃烧生成的氧化物是Na2O2。
6、(2010·北京东城区模拟)仅通过物理方法就能从海水中获得的物质是 ( )
A.钠、镁 B.溴、碘 C.食盐、淡水 D.氯气、烧碱
[解析]选C。海水蒸馏可得淡水,蒸发海水可以得到食盐。
5、(2010·福州模拟)北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析正确的是( )
A.K3C60中既有离子键,又有极性键
B.1mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
[解析]选C。A项,K3C60中有离子键,也有C原子之间形成的非极性共价键;B项1mol K3C60中含有的离子数目为4×6.02×1023,D项,C603-为一个离子,不能约分。
4、(2010·曲靖模拟)在120℃时,将2LH2O、1LN2、1LCO、1LO2和2LCO2组成的混合气体依次缓缓通过过量的热铜粉、过量过氧化钠和过量炽热木炭粉的三个反应管。经充分反应后,恢复到原来温度和压强。其气体体积是( )
A.6 L B.5L C.3.5L D.2.5L
[解析]选A。通过过量热铜粉后,剩余2LH2O、1LN2、3L CO2(CO变为了CO2),通过过量过氧化钠以后气体变为1LN2、2.5LO2,通过过量炽热木炭粉以后气体变为了1LN2、5LCO。
3、(2010·长沙模拟)由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为 ( )
A 1.75a% B 1-1.75a% C 1.25a% D 无法计算
[解析]选B。w(O)=1- a% (w(S))- 0.75a%(Na、H元素或者Mg元素的质量分数)。
2、(2010·湖北武昌区模拟)现有碳酸钠、碳酸氢钠、氢氧化钠、氯化铁和苯酚五种物质的溶液,它们之间有如图所示转化关系,图中每条线两端的物质均可以发生反应(图中各字母表示上述不同的物质),下列判断不合理的是( )
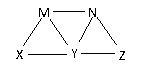
A.X一定是碳酸氢钠溶液 B.Y一定是氯化铁溶液
C.Z可能为碳酸钠溶液 D.M、N必定各为苯酚、氢氧化钠溶液中的某一种
[解析]选A。根据各种物质之间的反应,X可能为碳酸氢钠溶液或者碳酸钠溶液中的一种。
1、(2010·石家庄模拟)常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
A.MnO2 CuO FeO
B.(NH4)2SO4 K2SO4 NH4Cl
C.Na2CO3 NaHCO3 K2CO3
D.AgNO3 KNO3 Na2CO3
[解析]选C。A项可以用浓盐酸鉴别,B项可以用Ba(OH)2溶液鉴别,D项可以用稀盐酸鉴别。
16、(2010·潍坊模拟)A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的化学式是 ,该反应的化学方程式是:
。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是
[解析](1)若Y是黄绿色气体,则Y为Cl2。
(2)构成A的原子核外最外层电子数是次外层电子数的2倍,则Y为碳,B为浓硝酸.
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为Al或Fe, X应为铝盐或铁盐,又因A可溶于X溶液中,故可推知A为Fe,Fe在周期表的位置是第4周期 Ⅷ族。
Fe+ 2Fe3+ = 3Fe2+
m 2m 3m
由题意得:a-2m=3m m=0.2a 故被还原的n(Fe3+)=2m=0.4a
(4)化合物A溶于水电离出的阳离子和水作用的生成物可净化水,且A的水溶液与硝酸酸化的AgNO3溶液能产生白色沉淀,可知化合物A为AlCl3。B的焰色为黄色,故应为钠的化合物。因为A与B按物质的量之比1:4恰好反应,可知B为NaOH,反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O ,所以反应后的溶质为NaAlO2和NaCl,且溶液显碱性,溶液中离子浓度从大到小的顺序是c(Na+)>c(Cl-)>
c(AlO2-)>c(OH-)>c(H+)。
[答案](1)Cl2 ; MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)4:1 ; (3)①第4周期 Ⅷ族 ;NO ; ②0.4a
(4)c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
|

|
15、(2010·曲靖模拟)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
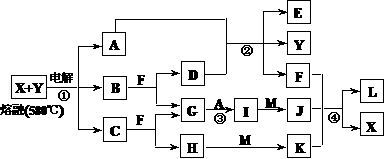
试回答下列有关问题:
(1)M的化学式 ,Y在实验室中的用途 (列举一例)。
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
(3)反应②的化学方程式是___________。
(4)反应④的离子反应方程式是 。
[解析]根据E是一种具有漂白作用的盐,Y易潮解,判断E为Ca(ClO)2,Y为CaCl2,则A和D为氯气和氢氧化钙,F为水,M为氧化铝,L为氢氧化铝。
[答案](1)Al2O3 用作干燥剂
(2)降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)Al3++3AlO2-+6H2O=4Al(OH)3↓
14、(2010·信阳模拟)由短周期元素组成的A、B两种盐可发生下列变化.且B的焰色反应呈黄色(图中其它生成物未列出)
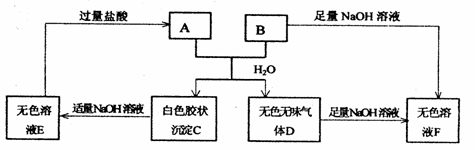
(1)A和B的混合物溶于水发生反应的离子方程式______________________________
(2)B、E两溶液混合反应时,可观察到的现象是_________________________________,
写出B→F反应的离子方程式________________
[答案](1)Al3++HCO3-==== Al(OH)3↓+CO2↑
(2)生成白色胶状沉淀 HCO3-+OH-====CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com