
题目列表(包括答案和解析)
8.(2010年德州模拟)今有室温下四种溶液,有关叙述不正确的是( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>③>④
C.等体积③、④两溶液与足量的Zn反应,产生气体量③>④
D.温度下降10 ℃,①②③④四种溶液的pH均不变
7.(2010年枣庄检测)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是 ( )
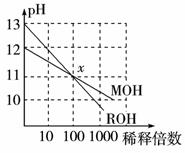
A.在x点时,ROH完全电离
B.在x点时[M+]=[R+]
C.MOH是一种强碱
D.稀释前,[ROH]=10[MOH]
6.(2009年济南模拟)取pH均为2的盐酸和醋酸各100 mL,分别加水稀释两倍后,再分别加入6.5 g锌粉,相同条件下充分反应,下列说法中,不正确的是( )
A.加水稀释后两溶液的pH不再相等
B.起始时醋酸与锌反应的速率大
C.醋酸与锌反应放出的氢气多
D.两者放出的氢气一样多
5.25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·-1L的氨水b L,②c(OH-)=10-3 mol·-1L的氨水c L,③c(OH-)=10-3 mol·-1L的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d
B.b>a=d>c
C.b>a>d>c
D.c>a=d>b
4.常温下,0.1 mol·-1L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-10,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·-1L
B.溶液中c(H+)+c(A-)=0.1 mol·-1L
C.与0.05 mol·-1L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
3.在由水电离产生的H+的浓度为1×10-13 mol·-1L的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42- ③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A.①③
B.③⑤
C.③④
D.②⑤
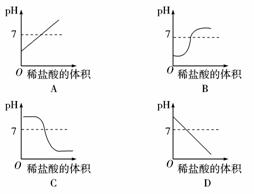
2.向盛有10 mL NaOH溶液的烧杯中逐滴滴加稀盐酸,下列图象能够体现溶液的pH变化情况的是( )
1.(2008年上海卷)常温下,某溶液中由水电离的c(H+)=1×10-13 mol·-1L,该溶液可能是( )
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液
④氢氧化钠水溶液
A.①④
B.①②
C.②③
D.③④
12.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
|
项目 |
H2 |
N2 |
NH3 |
|
起始时 |
5 mol·-1L |
3 mol·-1L |
0 |
|
2 s末 |
2 mol·-1L |
|
|
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=____________。若此时
已达平衡,则可求得平衡常数为____________。
(2)如下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是____________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
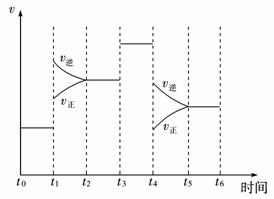
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH____________0(填“大于”或“小于”)。
(3)合成氨工业中采用了较高压强(20~50 MPa),而没有采用100 MPa或者更大压强,试解释没有这么做的理由:____________ ____________ 。
(4)在容积均为2 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol N2、6 mol H2和1 mol N2、3 mol H2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中N2
转化率分别为α甲、α乙,则甲容器中平衡常数表达式为____________(用含α甲的代数式表示),此时α甲____________(填“>”“<”或“=”)α乙。
11.(2008年上海卷)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K300 ℃>K350 ℃,则该反应是____________热反应。
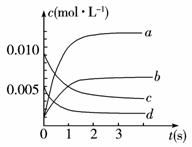
(2)右图中表示NO2的变化的曲线是____________。用O2表示从0~2 s内该反应的平衡速率v=____________。(3)能说明该反应已达到平衡状态的是____________。
a.v(NO2)=2v(O2)__________________ b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com