
题目列表(包括答案和解析)
2.(2009年广州综合)用于净化汽车尾气的反应:2NO(g)+2CO(g)=2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570 K时该反应正向进行的程度很大,故使用催化剂并无实际意义
1.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)=2HI(g)已知H2和I2的起始浓度均为0.10 mol·-1L时,达平衡时HI的浓度为0.16 mol·-1L。
若H2和I2的起始浓度均变为0.20 mol·-1L,则平衡时H2的浓度(mol·-1L)是( )
A.0.16
B.0.08
C.0.04
D.0.02
12.已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净的CuSO4溶液的方法,根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验过程如下图所示:

(1)步骤①所加的A的化学式为____________;加入A的作用是____________ ____________ 。
(2)步骤②中所用的部分仪器如图:则A、B分别连接直流电源的____________极和____________极(填“正极”或“负极”)。
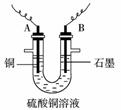
(3)电解开始一段时间后,在U形管中观察到的现象有__________________;电解的离子方程式为____________ 。
(4)下列实验操作中必要的是(填字母)____________。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为____________(用带有n、V的计算式表示)。
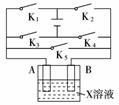
11.某课外活动小组装备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
|
|
A电极 |
B电极 |
X溶液 |
|
甲 |
Cu |
Zn |
H2SO4 |
|
乙 |
Pt |
Pt |
CuCl2 |
|
丙 |
Fe |
Cu |
? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为____________ 。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为______________;实验时应闭合的电键组合是____________。
(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K3
C.K1和K4 D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为
____________,实验时,应闭合的电键组合是____________(选项如上)。
10.(2009年海南卷)Li-SO2Cl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlClx-SO2Cl2。电池的总反应可表示为:4Li+2SO2Cl2=4LiCl+S+SO2↑。请回答下列问题:
(1)电池的负极材料为______________,发生的电极反应为______________。
(2)电池正极发生的电极反应为____________ 。
(3)SO2Cl2易挥发,实验室中常用NaOH溶液吸收SO2Cl2,有Na2SO3和NaCl生成。如果把少量水滴到SO2Cl2中,实验现象是_______________,反应的化学方程式为_______________。
(4)组装该电池必须在无水、无氧的条件下进行,原因是____________ 。
9.工业上处理含Cr2O72-酸性工业废水常用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间后有Cr(OH)3和Fe(OH)3沉淀产生。已知Fe3+和Cr3+在pH=4~5的水溶液中几乎完全水解生成氢氧化物沉淀,而此时Fe2+几乎不水解;③过滤回收沉淀,废水达到排放标准,试回答:
(1)电解时的电极反应:
阳极:____________ ,
阴极:____________ 。
(2)写出Cr2O72-转变为Cr3+的离子反应方程式:_______________。
(3)能否将Fe电极改成石墨电极?为什么?
8.(2009年济南模拟)电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如CO2+)氧化成高价态的离子(CO3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化。实验室用如右图装置模拟上述过程,下列说法正确的是( )

A.电极a可以是石墨,电极b可以是铜
B.电解后阴极附近H+浓度不变
C.CO3+氧化甲醇的离子方程式为:6CO3++CH3OH+H2O=CO2↑+6CO2++6H+
D.当1 mol甲醇被完全氧化时,阳极应该失去6 mol电子
7.(2008年天津卷改编)下列叙述正确的是( )
A.在原电池的负极和电解池的阳极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
6.如右图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是( )
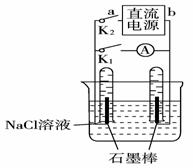
A.闭合K2、打开K1,试管内两极都有气泡产生
B.闭合K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为负极,b为正极
C.闭合K2、打开K1,一段时间后,再闭合K1、打开K2,电流表指针偏转方向与K1、K2均闭合时电流表指针偏转方向一致
D.闭合K2、打开K1,一段时间后,再闭合K1、打开K2,电流表指针不会偏转
5.对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是( )
A.以铜为电极,电解1 mol·-1L H2SO4溶液
B.以石墨为电极,电解1 mol·-1L KBr溶液
C.以石墨为电极,电解含酚酞的饱和食盐水
D.以铜为电极,电解CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com