
题目列表(包括答案和解析)
12.(2010年枣庄一模)下表为元素周期表的一部分,请参照①~⑨在周期表中的位置,回答下列问题。

(1)④⑤⑥的原子半径由小到大的顺序是____________(填化学式)。
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是-__________________ 。
(3)写出元素①与元素④按1∶1形成化合物X的化学式____________,元素③形成4核10电子化合物Y的化学式是____________。
(4)中学化学常见物质的转化关系如下:

a.将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,红褐色胶体F粒子直径大小的范围为____________。
b.写出D与Y的水溶液反应的离子方程式:____________ -____________________________________ 。
c.红棕色G和单质⑨与足量的稀硫酸充分反应,生成FeSO4和H2,Fe2+和H2的质量比为112∶1,若将生成的Fe2+分成4等份,就来源看,____________份是来自Fe3+的还原产物,
____________份是来自H+氧化单质铁的产物。
11.原子序数递增的部分短周期主族元素的原子半径数据如下表:
|
元素 |
A |
B |
D |
E |
F |
G |
M |
N |
P |
|
原子半径/nm |
0.077 |
0.075 |
0.074 |
0.071 |
0.186 |
0.160 |
0.143 |
0.102 |
0.099 |
(1)已知[A、B、D、E、N、P为非金属元素,且均不与F、G、M中任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中。
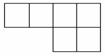
(2)B在周期表中的位置为____________,AD2的电子式为____________。(3)N的最高价氧化物的水化物与A单质反应的化学方程式为____________ 。(4)M的最高价氧化物的水化物是药物“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为
-______________________________________________________ ,F的最高价氧化物的水化物也可以中和胃
酸,不用其治疗胃酸过多的原因是____________ 。
(5)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是____________,反应的化学方程式为-____________________________________。
10.(2010年泰安一模)短周期的四种元素A、B、C、D,原子序数依次增大,A、B、C三种元素原子核外电子层数之和是5,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外层电子数是它的电子层数的2倍,A和C可以形成化合物CA3;
B和D的原子序数之比为3∶4。
(1)A的元素符号为____________,C的元素符号为____________,D的简单离子的离子结构示意图为____________,B2A2的电子式为____________。
(2)上述四种元素中原子半径最大的是____________(用元素符号表示)。
(3)写出两种由上述四种元素组成的无机物的化学式-__________________ 。
9.下表是元素周期表的一部分,已知元素⑤⑥⑦均可构成电子数为18的微粒。
|
① |
② |
③ |
④ |
|
|
|
|
⑤ |
⑥ |
⑦ |
(1)某元素能形成的化合物种类最多,该元素是____________(填编号)。该元素有多种同位素,在科学上均有重要的应用,写出其中任意一种同位素的某一项用途-______________________________________________________ 。
(2)⑤号元素可形成两种18电子的阴离子,其离子符号分别为____________、____________。
(3)①~⑥号六种元素的简单氢化物中,沸点最高的是-__________________ (填分子式)。
(4)①~⑦号七种元素中,原子半径最小的元素具有的性质是____________(填序号)。
A.单质可与水反应,形成两种化合物
B.单质可与⑥的钠盐溶液反应,置换出元素⑥的单质
C.气态氢化物的水溶液呈弱酸性
D.可以用玻璃器皿在实验室制取该元素的气态氢化物
8.从下列事实所得出的相应结论正确的是( )
|
|
实验事实 |
结论 |
|
A |
A元素的原子半径比B元素的原子半径大 |
周期表中A位于B的下一周期 |
|
B |
将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) |
酸性:H2CO3>H2SiO3 |
|
C |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
7.(2009年潍坊模拟)现有下列短周期元素的数据
 元素编号元素性质 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法中,正确的是( )
A.元素原子序数④小于⑦
B.②、③号元素处于同一周期
C.⑤号元素最高价氧化物的水化物酸性最强
D.⑧号元素是非金属元素
6.(2010年临沂模拟)X、Y、Z分别是三种单质,它们都是常见的金属和非金属,M、N、R是常见的三种氧化物,其中一种具有高熔点,而且有如下反应(条件未标出,方程未
配平):
(1)X+Z→M;
(2)M+X→N;
(3)M+Y→R+X。若X是非金属,则组成Y单质的元素在周期表中的位置是( )
A.第2周期ⅣA族
B.第2周期ⅥA族
C.第3周期ⅡA族
D.第3周期ⅣA族
5.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
4.下列叙述中能肯定A金属比B金属活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子少
B.A原子电子层数比B原子的电子层数多
C.1 mol A与酸反应生成的H2比1 mol B与酸反应生成的H2多
D.常温时,A能从水中置换出氢,而B不能
3.如下图表示一些元素原子半径规律性的变化示意图。由此图不能得出的结论是(不考虑稀有气体元素)( )
A.当电子层数相同时,核电荷数越小,原子半径越大
B.当最外层电子数相同时,质子数越多,原子半径越大
C.r(F-)<r(Cl-)<r(Br-)<r(I-),r(K+)>r(Na+)>r(Mg2+)>r(Al3+)
D.原子电子层数越多,对应的原子半径越大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com