
题目列表(包括答案和解析)
8.(2009年深圳二调)一定条件下在固定容积的密闭容器中充入a mol O2和b mol SO2发生反应:2SO2+O2=2SO3。反应过程中物质的浓度变化如右图所示。下列有关判断正确的是( )

A.Y线是表示SO2的浓度变化
B.反应在t1时刻达到平衡状态
C.平衡状态时,容器中气体密度不再改变
D.再往该容器中充入a mol O2和b mol SO2,该条件下重新达到平衡时c(SO3)>1.2 mol·-1L
7.(2009年广州调研)工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-1025 kJ/mol氧化过程中还伴随有N2O、N2等物质生成。有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反应达到平衡后,3v正(NH3)=2v逆(H2O)
C.其他条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
6.(2009年广州四校联考)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)=CH3OH(g),根据题意,以下说法正确的是( )
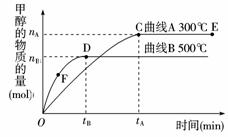
A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH>0
B.容器中气体的总物质的量E点大于D点
C.F点的正反应速率大于逆反应速率
D.v(甲醇)=nB/3tB mol/(L·min)表示500 ℃时以上反应在D点的速率
5.(2009年全国卷Ⅰ)下图表示反应X(g)=4Y(g)+Z(g),ΔH<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是( )

A.第6 min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
4.一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7%
B.20.0%
C.80.0%
D.83.3%
3.(2008年北京卷)工业上制备纯硅反应的热化学方程式如下:SiClx(g)+2H2(g)=Si(s)+4HCl(g);ΔH=+Q kJ·mo-1L(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiClx的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·-1L,则H2的反应速率为0.03 mol·-1L·miN-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·-1L的NaOH溶液恰好反应
2.(2009年广州综合)用于净化汽车尾气的反应:2NO(g)+2CO(g)=2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570 K时该反应正向进行的程度很大,故使用催化剂并无实际意义
1.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)=2HI(g)已知H2和I2的起始浓度均为0.10 mol·-1L时,达平衡时HI的浓度为0.16 mol·-1L。
若H2和I2的起始浓度均变为0.20 mol·-1L,则平衡时H2的浓度(mol·-1L)是( )
A.0.16
B.0.08
C.0.04
D.0.02
12.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
|
项目 |
H2 |
N2 |
NH3 |
|
起始时 |
5 mol·-1L |
3 mol·-1L |
0 |
|
2 s末 |
2 mol·-1L |
|
|
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=____________。若此时
已达平衡,则可求得平衡常数为____________。
(2)如下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是____________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6

若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH____________0(填“大于”或“小于”)。
(3)合成氨工业中采用了较高压强(20~50 MPa),而没有采用100 MPa或者更大压强,试解释没有这么做的理由:____________ ____________ 。
(4)在容积均为2 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol N2、6 mol H2和1 mol N2、3 mol H2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中N2
转化率分别为α甲、α乙,则甲容器中平衡常数表达式为____________(用含α甲的代数式表示),此时α甲____________(填“>”“<”或“=”)α乙。
11.(2008年上海卷)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K300 ℃>K350 ℃,则该反应是____________热反应。
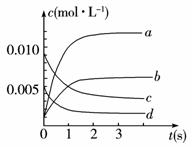
(2)右图中表示NO2的变化的曲线是____________。用O2表示从0~2 s内该反应的平衡速率v=____________。(3)能说明该反应已达到平衡状态的是____________。
a.v(NO2)=2v(O2)__________________ b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com