
题目列表(包括答案和解析)
22.(2007·广东汕尾调研)X、Y、Z为短周期元素的单质,X、Y的组成元素为同主族元素,U、V为它们的化合物,这些物质之间的转化关系如右图所示,其中反应条件和某些产物已经略去。
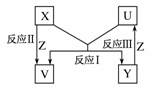
(1)若V是水,则:①X是________、U是________
②由于U有剧毒,工业上产生的U要经过处理变成单质Y后方能排放,以防止大气污染。富玛克斯法治理U的方法和步骤如下:
第一步:用2%-3%的Na2CO3溶液作为吸收剂生成2种酸式盐;
第二步:再加入一种RNO(溶液)(R表示芳香烃基)与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
第三步:第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
第四步:RNHOH与空气中的氧发生反应又得到RNO。
则:第一步反应的化学方程式为___________________。
总反应的化学方程式为: ____________________。
请对富玛克斯法的优点做一简要评价: ________________。
(2)若U、V均为氧化物,则:①写出反应Ⅰ的化学方程式: _____________________。
②计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成分是U,该材料的名称是:______________________。
③这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因________________________________________________________________________
________________________________________________________________________。
解析:因为X、Y是同主族元素,且由题意可推知X+U―→V+Y是一个置换反应。(1)V是水,U有剧毒,可推出U是H2S,X是O2,Y是S。(2)若U、V均为氧化物,则符合它的置换反应是C与SiO2的反应,故X是C,U是SiO2,Y是Si,V是CO。
答案:(1)①O2 H2S
②Na2CO3+H2S===NaHCO3+NaHS 总反应为:2H2S+O22H2O+2S↓;RNO反应前后不变,起到催化剂的作用,是一条绿色工艺流程。
(2)①SiO2+2CSi+2CO↑ ②光导纤维 ③SiO2+2OH-===SiO+H2O
21.(2008·烟台期中)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:
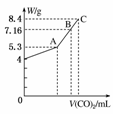
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL (标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
解析:CO2通入NaOH溶液中,首先生成Na2CO3和水,继续通入CO2,Na2CO3与CO2和水继续反应生成NaHCO3。这两种情况下,所得产物的质量比为53?84。由此不难判断A点时M的化学式为Na2CO3;据此可以计算通入CO2的量;同理可以判断C点时M为NaHCO3,据此也可计算CO2的用量。从图可知NaOH的质量为4 g,n(NaOH)=0.1 mol。完全转化为Na2CO3时,m(Na2CO3)=5.3 g,完全转化为NaHCO3时,m(NaHCO3)=8.4 g,因B点时M质量为7.16 g,5.3>7.16>8.4,知M为Na2CO3和NaHCO3的混合物。设B点时Na2CO3的物质的量为x mol,NaHCO3的物质的量为y mol,则有:2x+y=0.1,106x+84y=7.16,解得:x=0.02 mol,y=0.06 mol,所以V(CO2)=(0.02+0.06) mol×22.4 L/mol×1000 mL/L=1792 mL。可进一步计算出NaOH溶液的浓度为1.0 mol·L-1。
答案:(1)Na2CO3 1120 (2)NaHCO3 2240 (3)Na2CO3和NaHCO3 1792 (4)1.0 mol·L-1
20.按要求完成下列各题的填空。
(1)若CO2中混有CO,除去的方法是__________________________;
(2)若CO2中混有HCl,要得到纯净的CO2,其方法是_______________________;
(3)将镁条在空气中点燃后伸入装有纯净CO2的集气瓶中,观察到的现象是(不必写产物的名称或分子式)_______ ______________________;
(4)在没有现成的CO2气体发生器的情况下,请选用下图中的部分仪器,装配一个简易的、能随用随开、随关随停的CO2气体发生装置,应选用的仪器是(填入编号)________;
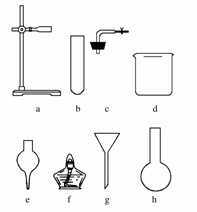
(5)若用上述装置产生CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状大理石,比较合理的方案应选用的药品是________________________
解析:(1)利用CO有还原性,CO2没还原性这一性质差异,将含CO杂质的气体通过灼热的CuO除去CO。
(2)因为CO2是酸性氧化物,因而在除去CO2中的HCl时,既要考虑选择碱性试剂,又要尽量减少CO2在其中的溶解度,同时要注意题目要求得到“纯净的CO2”,所以这里除要用饱和NaHCO3溶液(或水)洗涤外,还要用浓硫酸来干燥(除去水分)。
(3)镁条点燃在纯净的CO2中燃烧,是课堂演示实验,如果学生在实验时仔细观察,回答此问并不困难。
(4)本题实质是考查学生是否掌握启普发生器的原理,用干燥管、烧杯和单孔塞组合,可以取代启普发生器中的“球形漏斗”和“容器”这两个核心部分,从而达到随关随停的目的。
(5)选用试剂时要注意,题目没有提供学生熟悉的盐酸,而硫酸会与大理石生成CaSO4沉淀,包在其表面,阻止CaCO3继续和酸作用产生CO2;块状Na2CO3遇酸会溶解,使制气装置起不到随关随停的作用,本题只能选用大理石、浓硝酸和水。
答案:(1)通过灼热的CuO (2)先用饱和的NaHCO3溶液洗涤(或用水洗),再用浓硫酸干燥 (3)镁条继续燃烧,瓶壁有白色和黑色固体 (4)a、c、d、e (5)浓硝酸、水、块状大理石
19.(2009·重庆)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为_______________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是_______________________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
解析:由(1)知,X为Al,由(3)并结合题干“耐热冲击材料”确定Y为N,A为AlN。
答案:(1) 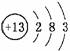 (2)Al3++4OH-===AlO+2H2O
(2)Al3++4OH-===AlO+2H2O
(3)①?N⋮⋮N? 三角锥形 ②AlN
(4)4Al+3TiO2+3C2Al2O3+3TiC
18.(2009·北京)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件已略去)。下列推断不正确的是 ( )
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO===H2O+CO,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是Na+[?····?····?]2-Na+
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
解析:将各选项代入检验,如A项,A为F2也符合:
F2
D项:若X为铝盐,则D为Al(OH)3, A为Na2O2,则有:
Na2O2
答案:A
17.(2009·福建)能实现下列物质间直接转化的元素是 ( )
单质氧化物酸或碱盐
A.硅 B.硫
C.铜 D.铁
解析:SSO2H2SO3Na2SO3
另外SiO2、CuO、Fe3O4或Fe2O3均不能和H2O反应。
答案:B
16.在石灰窑中烧制生石灰,1 mol CaCO3完全分解所需要的能量,可由燃烧0.453 mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是 ( )
A.0.43 B.0.46
C.0.49 D.0.52
解析:燃烧0.453 mol碳需要O2 0.453 mol,由空气提供,则N2的物质的量为0.453 mol×=1.704 mol。CO2的体积分数为=0.46,B正确;实际生产中,需通入足量空气,则气体中会有过量的空气,CO2的体积分数也可能小于0.46。
答案:AB
15.(2007·广东省广州市模拟)下列各组物质中,不是按bca(“→”表示一步完成)关系相互转化的是 ( )
|
选项 |
a |
b |
c |
|
A |
Fe |
FeCl3 |
FeCl2 |
|
B |
Cl2 |
NaClO |
NaCl |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
HNO3 |
NO |
NO2 |
解析:SiO2不能直接生成H2SiO3,H2SiO3也不能直接生成Si。
答案:C
14.(2007·临沂模拟)下列离子方程式的书写正确的是 ( )
A.水玻璃中通入过量的二氧化碳:
Na2SiO3+CO2+H2O===2Na++CO+H2SiO3↓
B.澄清石灰水中通入过量二氧化碳:
Ca(OH)2+2CO2===Ca2++2HCO
C.二氧化硅溶于氢氟酸溶液中
SiO2+4H++4F-===SiF4↑+2H2O
D.二氧化硅溶于烧碱溶液中:
SiO2+2OH-===SiO+H2O
解析:A、B中的Na2SiO3、Ca(OH)2应拆成离子,C中HF酸为弱酸,应写化学式。
答案:D
13.能证明碳酸比硅酸的酸性强的实验事实是 ( )
A.H2CO3不如H2SiO3稳定
B.高温下能发生反应:Na2CO3+SiO2Na2SiO3+CO2↑
C.CO2溶于水生成碳酸,而SiO2却不溶于水
D.CO2通入Na2SiO3溶液中有胶状沉淀生成
解析:D项为强酸制弱酸。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com