
题目列表(包括答案和解析)
22.下列说法正确的是 ( )
A.0.2mol·L-1的醋酸钠溶液中,c(Na+)=c(CH3COO- )
B.室温下,pH=3盐酸和pH=11的氨水等体积混合后的溶液pH小于7
C.向氯化钠溶液中滴加稀硝酸得到pH=5的混合溶液中,c(Na+)=c(Cl-)
D.0.1mol·L-1的碳酸钠溶液中,c(H+)-c(OH-)=c(CO32-)+c(H2CO3)
21.对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
C.溶液的pH相同时,由水电离出的c(H+)大小顺序是③>②>①
D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③
20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH 。下列叙述不正确的是 ( )
3Zn(OH)2 + 2Fe(OH)3 + 4KOH 。下列叙述不正确的是 ( )
A.放电时锌做负极
B.充电时氢氧化铁被氧化
C.充电时电池的正极和电源的正极相连
D.放电时每转移3 mole-,有2mol FeO42-被还原
19.室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是( )
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
C.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足
c(B+)>c(A-)>c(H+)>c(OH-)
18.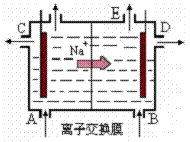 右图为阳离子交换膜法电解饱和食盐水原理示意图。
右图为阳离子交换膜法电解饱和食盐水原理示意图。
下列说法不正确的是 ( )
A.从E口逸出的气体是Cl2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,
精制时先加Na2CO3溶液
17.已知0.1mol L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是 ( )
A.在Na2A、NaHA两溶液中,都含有5种离子,且种类相同
B.HA-水解的离子方程式为:HA-+H2O H3O++A2-
H3O++A2-
C.在NaHA溶液中一定有: c(OH-)=c(HA-)+ 2c(H2A)+ c(H+)-c(Na+)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)> c(H+)>c(OH-)
16.为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案。其中不合理的是( )
A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸
B.室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是
弱酸
C.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸
D.在相同条件下,对0.1 mol/L的盐酸和0.1 mol/L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
15.下列关于电解质溶液的叙述正确的是 ( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液pH大
13.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3溶液
C.酸性KMnO4溶液 D.AgNO3溶液
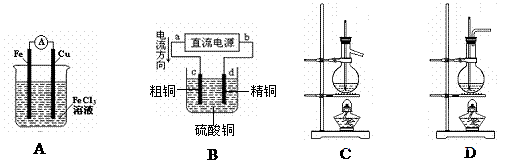 14.利用下列装置(部分仪器已省略),不能顺利完成对应实验的是 ( )
14.利用下列装置(部分仪器已省略),不能顺利完成对应实验的是 ( )
A.原电池 B.精炼铜 C.石油的分馏 D.实验室制乙烯
12.美国科学家发表论文,宣布发现了铝的“超级原子”结构--A1 13和A114。已知这
“超级原子”最外层电子数之和为40个处于相对稳定状态。下列说法正确的是( )
A.All3和A114互为同位素
B.All3超原子中Al原子间通过离子键结合
C.A114最外层电子数之和为42,与第IIA族元素的性质相似
D.All3和A114都具有较强的还原性容易失去电子生成阳离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com