
题目列表(包括答案和解析)
3.化学平衡移动的分析
影响因素主要有:浓度、压强、温度,其移动可通过勒沙特列原理进行分析。化学平衡移动的实质是浓度、温度、压强等客观因素对正、逆反应速率变化产生不同的影响,使V正≠V逆,原平衡状态发生移动。
2.化学反应速率的计算与分析
要充分利用速率之比等于化学方程式中的计量数之比。
1.化学平衡状态的判断
化学反应是否达到平衡状态,关键是要看正反应速率和逆反应速率是否相等及反应混合物中各组分百分含量是否还随时间发生变化。
25、(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是____________和____________,阴离子是_____________。
(2)试通过计算确定该结晶水合物的化学式。
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol/L,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
24、(8分)将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g/cm3氨水。
(1)求所得氨水的物质的量浓度?
(2)取上述氨水30.0mL与70.0ml 2.00mol/L的AlCl3溶液相混合,产生的白色沉淀的质量是多少?
(3)往上述反应后未过滤的溶液中加入一定体积的5mol/L的NaOH溶液后,混合后体系中沉淀的质量与上述(2)中产生的沉淀质量相等,求加入的NaOH溶液的体积是多少?
23、(10分)有机物A、B、C、D、E、F、G的相互转化关系如图所示。5.2g F能与100mL1mol/LNaOH溶液恰好完全中和,0.1mol F还能与足量金属钠反应,在标准状况下放出2.24L H2。D的分子式为C3H3O2Na,能使溴水褪色,E的分子中含有羧基。试回答:
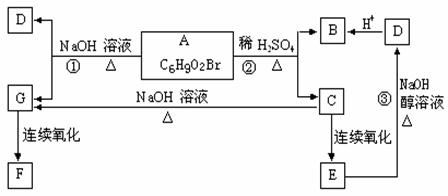
(1)写出下列物质的结构简式:
F D
(2)写出下列反应的反应类型:
反应② 反应③
(3)写出下列反应的化学方程式:
B与溴水反应:
反应①:
22、(8分)有机物A与CH3COOH无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答下列问题。
(1)符合条件的相对分子质量最小的有机物A是 (写结构简式);
(2)若A与乙酸相对分子质量相等,则A的结构简式可以是 ;
(3)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A的分子式为
。如果A中含苯环结构且能发生银镜反应,符合条件的A的同分异构体有
(写两个即可)。
21、(14分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和以及防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强);
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol/LNaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示) 。
写出硼酸与NaOH溶液反应的化学方程式: 。
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
;
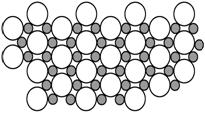 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(6)硼烷(B2H6)气体在空气中能剧烈燃烧生成固态氧化物,已知每生成1mol液态水可放出722kJ的热量,请写热化学方程式: 。
20、(8分)某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、而腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:
 ①B + NH3 C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解,得到A。
①B + NH3 C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解,得到A。
|
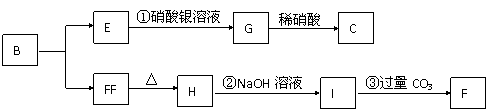
请回答下列问题:
(1)写出化合物B和化合物G的化学式 、 。
(2)A可能所属的晶体类型是 ,在A晶体中,每个Si原子周围结合的另一种原子的个数是 。
(3)写出反应②的离子方程式: ;
(4)分析反应③,你能得出的结论是:
。(合理均计分)
19、(8分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。单质C是一种黄绿色气体,A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种气体X,且X分子与B2A分子中的电子数相等。B与C可形成气体Y,且Y分子与最简式为BA的分子中的电子数相等。
请回答:
(1)写出DA2的化学式: ;写出最简式为BA的物质的电子式
(2)写出单质C与过量X反应的化学方程式
(3)写出B4A3D2的水溶液呈弱酸性的原因(用离子方程式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com