
题目列表(包括答案和解析)
24.在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g)+Q(Q>0)
2SO3(g)+Q(Q>0)
(1)写出该反应的化学平衡常数表达式K=__________
(2)降低温度,该反应K值__________,二氧化硫转化率_____,化学反应速度_____(均填:增大、减小、不变)。
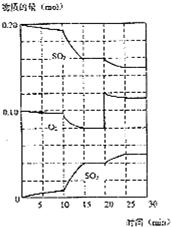
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是__________
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是_____________________
10 min到15 min的曲线变化的原因可能是_____
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
23.某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4¾®MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是__________
 (2)如果该反应方程式中I2和KIO3的系数都是5
(2)如果该反应方程式中I2和KIO3的系数都是5
① KMnO4的系数是_____
② 在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 ¾®
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是:______________________
24.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg¾®Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_____价。
(2)以上反应中的氧化剂为_____,当有1 mol CuI参与反应时,转移电子_____mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
___Cu2++___I-¾®___CuI+___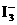
2004年
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ/mol):
|
|
失去第一个电子 |
失去第二个电子 |
失去第三个电子 |
失去第四个电子 |
|
锂 |
519 |
7296 |
11799 |
|
|
X |
502 |
4570 |
6920 |
9550 |
|
Y |
580 |
1820 |
2750 |
11600 |
① 通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_____________________________________________
② 表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和J形成化合物的化学式____
③ Y是周期表中_____族元素。
④ 以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
24.右表是元素周期表一部分。
表中所列的字母分别代表某一
化学元素。
(1)下列_____组元素的单质
可能都是电的良导体。
① A、C、H ② B、G、K ③ C、H、L ④ D、E、F
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
23.钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)一Q
NaCl(l)+K(g)一Q
|
压强(kPa) |
K的沸点(℃) |
Na的沸点(℃) |
KCl的沸点(℃) |
NaCl的沸点(℃) |
|
13.33 |
590 |
700 |
|
|
|
53.32 |
710 |
830 |
|
|
|
101.3 |
770 |
890 |
1437 |
1465 |
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是_______________
|
25.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:_____>_____>H2O、HF;SiH4>PH3>_____>_____。
(2)化合物的毒性:PH3>NH3;H2S_____H2O;CS2_____CO2;CCl4_____CF4。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是____________________
(4)然而,这种致冷剂造成了当今的某一环境问题是______________________________
但求助于周期表中元素及其化合物的__________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。
① 毒性 ② 沸点 ③ 易燃性 ④ 水溶性 ⑤ 颜色
(a)①②③ (b)②④⑤ (c)②③④
2003年
23.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2¾®KOCN+2KCl+H2O。被氧化的元素是_____
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
___KOCN+___KOH+___Cl2¾®___CO2+___N2+___KCl+___H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_____g。
|
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表。
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________
(2)该反应为__________(填:吸热、放热)反应。
(3)能判断该反应是否达到化学平衡状态的依据是_____
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
24.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
序号 |
时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A物质浓度的变化表示的平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度C2=_____mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________________
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3_____V1(填:>、=、<),且C3_____1.0 mol/L(填:>、=、<)。
(4)比较实验4和实验1,可推测该反应是_____反应(填:吸热、放热)。理由是_______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com