
题目列表(包括答案和解析)
12.气化和液化是使煤变成清洁能源的有效途径。煤的气化的重要反应是:C+H2O(g)CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO、H2合成有机物的化学称为一碳化学。如下图是合成某些物质的路线:
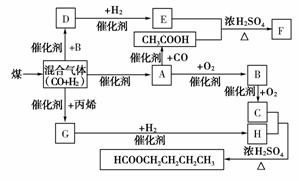
其中,D易溶于水,且与CH3COOH互为同分异构体,F分子中的碳原子数是D中的3倍,H经催化氧化可得到G。请回答下列问题:
(1)写出下列物质的结构简式:A:__________,H:__________;指出A和H的关系:________。
(2)利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可合成醛、酸、酯等多种产物,下列表述正确的是________。
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可得到不同的产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
④从合成气出发生成气态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有烯烃或水
A.①②④ B.②③④
C.②④⑤ D.③④⑤
(3)写出下列反应的化学方程式:
①CH3COOH+E―→F:______________________________________________________________;
②D与新制氢氧化铜加热:____________________________。
[答案] (1)CH3OH CH3CH2CH2CH2OH 同系物
(2)B (3)①2CH3COOH+HOCH2CH2OH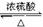
CH3COOCH2CH2OOCCH3+2H2O
②HOCH2CHO+2Cu(OH)2HOCH2COOH+Cu2O↓+2H2O
11.海水中蕴藏着丰富的资源。海水综合利用的流程图如下:
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100 mL NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是________________________________________________________________________,
目的是 。
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点________________________________________________________________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?________________________________________________________________________
________________________________________________________________________。
[答案] (1)①2NaCl(熔融)2Na+Cl2↑ ②13 ③NaCl+H2ONaClO+H2↑
(2)①在HCl气流中 抑制MgCl2水解
②电解产生的Cl2用于制取HCl气体
③不同意,因为MgO熔点很高,熔融时因耗费大量的能量而增加生产成本
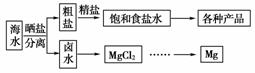
10.工业上对海水资源综合开发利用的部分工艺流程如图所示。
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是 。电解槽中的阳极材料为 。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备? (填“是”或“否”)。原因是 。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是 。
[解析] (1)电解饱和食盐水用的是阳离子交换膜,而在食盐水中的阳离子只有H+和Na+,电解时,H+在阴极上生成氢气,Na+在外加电场作用下向阴极运动,所以通过离子膜和隔膜的是Na+。由于阳极上发生氧化反应,是溶液中Cl-放电生成Cl2,所以必须用惰性电极,工业上一般用钛(表面涂有钌氧化物),也可以用石墨电极。
(2)在该流程开始时向苦卤中加入硫酸,因CaSO4微溶于水,先形成CaSO4沉淀而将Ca2+除去。若先制取Mg(OH)2,加入的石灰水会有部分与硫酸反应生成CaSO4而使制得的Mg(OH)2不纯净。
(3)CCl4是一种易挥发、有毒的液体,所以此流程中不用CCl4萃取的方法,而是利用溴的挥发性,向得到的含溴水的海水中吹入热空气,使溴挥发出来。与萃取相比,该方法简单、实用、经济、无污染。
[答案] (1)阳离子(或Na+) 钛(或石墨)
(2)否 如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
(3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低;环境污染严重
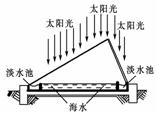
9.地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如图利用海水得到淡水的方法为________。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图。
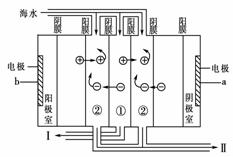
a是电源的 极;Ⅰ口排出的是 (填“淡水”或“浓水”)。
(3)海水淡化后的浓水中含大量盐分,排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
①电解前需要把浓水精制,加入试剂的顺序为________________________________________________________________________
;
②用离子膜电解槽电解食盐水的化学方程式为________________________________________________________________________
。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在,每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为____________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为________________________________________________________________________。
[解析] (1)海水经过蒸发和冷凝得到淡水,原理与蒸馏相同,故方法可归类为蒸馏法;(2)从阴极接电源负极,阳极接电源正极可知a是电源的负极;利用电场作用,使海水中阴、阳离子分别向阳、阴极定向移动,但在阳膜和阴膜的离子选择性透过作用下,使有的间隔内离子浓度变大(如②间隔),有的间隔内离子浓度变小(如①间隔),即Ⅰ口排出的是淡水;(3)浓水需精制后才能电解,精制时一般先加烧碱除去Mg2+、Fe3+等,再加氯化钡除去SO42-,再加碳酸钠除去Ca2+和过量的Ba2+,过滤出沉淀后加盐酸调节pH;(4)根据离子交换树脂交换溶液中阳离子的离子方程式,迁移到交换铀离子,一定注意铀离子带4个正电荷,用酸处理交换后的树脂又得到铀离子和树脂。
[答案] (1)蒸馏法 (2)负 淡水 (3)①NaOH、BaCl2(NaOH和BaCl2位置可互换)、Na2CO3、盐酸 ②2NaCl+2H2O2NaOH+H2↑+Cl2↑ (4)4HR+U4+===UR4+4H+ UR4+4H+===4HR+U4+
8.下列说法中,不正确的是( )
A.石油化学工业是以石油为原料,既生产石油产品又生产化学品的石油加工业
B.石油的催化裂化既能提高汽油产量,又能提高汽油的质量
C.石油的裂解和裂化都是化学变化,但二者的目的不一样
D.烷烃在裂解过程中既可发生断链裂解又可发生脱氢裂解
[解析] 此题意在考查学生对石油炼制及石油化工基本工艺的原料、原理的了解。石油化学工业的原料是石油和天然气,因此A不正确。石油催化裂化既能提高汽油产量又能提高汽油质量,裂解是深度裂化,以获取化工原料--乙烯、丙烯、丁烯为生产目的,故B、C均正确。烷烃裂解方式主要有两种,即断链和脱氢,可表示为Cm+nH2(m+n)+2―→CnH2n+CmH2m+2,CnH2n+2―→CnH2n+H2,故D正确。
[答案] A
7.工业上获得苯主要通过( )
A.煤的干馏 B.石油常压分馏
C.石油减压分馏 D.石油催化裂化
[解析] 煤的干馏产品煤焦油是芳香烃和杂环化合物的混合物,从中可提取出苯。故选A。
[答案] A
6.工业上获得大量的乙烯、丙烯、丁二烯的方法是( )
A.石油分馏 B.高温干馏
C.石油裂化 D.石油裂解
[解析] 此题是对石油化工工业中裂解的考查。石油裂解是以获取化工原料(主要是烯烃)为目的的工业生产,与石油裂化有区别(主要目的是获得轻质燃料油),而石油分馏是对石油的初级加工,将石油分离成沸点不同的产物。高温干馏则是煤综合利用的主要方式。
[答案] D
5.(海南高考)石油裂化的主要目的是为了( )
A.提高轻质液体燃料的产量 B.便于分馏
C.获得短链不-饱和气态烃 D.提高汽油的质量
[答案] A
4.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
[答案] D
3.下列关于离子交换膜电解槽的叙述,错误的是( )
A.精制的饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为NaOH和氢气
D.电解槽的阳极用金属铁网制成
[解析] 离子交换膜电解槽产品为阳极Cl2,阴极NaOH和H2,阳极发生氧化反应,2Cl--2e-===Cl2 ↑,若是铁做阳极,则Fe原子失去电子,阳极不会得到Cl2,阴极发生还原反应,2H++2e-===H2↑,需补充H2O,Na+自阳极室进入阴极室后,与OH-形成NaOH。故选D。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com