
题目列表(包括答案和解析)
9.下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是 ( )
①金属钠投入到FeCl3溶液
②过量的NaOH溶液和明矾溶液
③少量的电石投入过量的NaHCO3溶液
④Na2O2投入FeCl2溶液
A.① B.③
C.②③ D.①③④
[解析] ①钠先和水反应生成氢氧化钠和氢气,氢氧化钠再与FeCl3反应生成沉淀;③CaC2与H2O反应生成乙炔气体和Ca(OH)2,Ca(OH)2再与NaHCO3反应生成CaCO3沉淀;④Na2O2与水反应生成氧气和NaOH,NaOH、O2与FeCl2溶液反应最终生成Fe(OH)3沉淀。
[答案] D
8.一场盛大的焰火晚会上,焰火绽放出的五颜六色是一些金属离子魅力的展示。焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂。下列说法正确的是 ( )
A.碳酸铜因为受热分解才发出绿色的光
B.氯酸钾的主要用途是产生紫色的烟火
C.镁铝合金粉在烟火中发出耀眼的白光
D.黑火药的主要成分是木炭、硫磺
[解析] KClO3主要是作氧化剂,与木炭、硫磺组成炸药。
[答案] C
7.碱金属(如锂、钠、钾、铷等)溶于汞中可形成良好的还原剂“汞齐”。取7 g某种碱金属的汞齐与水作用,得到2.24 L(标准状况)氢气,并得到1 L密度为ρ g·cm-3的溶液,则溶液中溶质的质量分数可以是 ( )
A.% B.%
C.% D.%
[解析] 汞不能与水反应,汞齐中的碱金属(M)与水反应,由化学方程式:2M+2H2O===2MOH+H2↑,可知碱金属的物质的量为0.1 mol×2=0.2 mol,碱金属的摩尔质量小于=35 g·mol-1。相对原子质量小于35的碱金属只有Li和Na,根据LiOH和NaOH的摩尔质量进行计算,只有NaOH和选项相符。
[答案] A
6.已知相对原子质量:Li 6.9,Na 23,K 39,Rb 85。今有某碱金属M及其氧化物M2O组成的混合物10.8 g,加足量水充分反应后,溶液经蒸发和干燥得固体16 g,据此可确定碱金属是 ( )
A.Li B.Na
C.K D.Rb
[解析] 采用极端假设法做题,若10.8 g全为M,由M→MOH的Δm可计算出M的相对原子质量为35.31;若10.8 g全为M2O,由M2O→2MOH,可计算出M的相对原子质量为10.69;故M的实际相对原子质量在10.69与35.31之间,只有Na(相对原子质量为23)符合题意。
[答案] B
5.钡和钠相似,也能形成含O的过氧化物,下列叙述中正确的是 ( )
A.过氧化钡的化学式为Ba2O2
B.O的电子式为: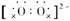
C.反应Na2O2+2HCl===2NaCl+H2O2为氧化还原反应
D.过氧化钡和过氧化钠都具有强氧化性
[解析] 过氧化钡的化学式为BaO2;O的电子式为:
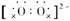 ;Na2O2+2HCl===2NaCl+H2O2中所有元素的化合价都未发生变化,故A、B、C项错误。
;Na2O2+2HCl===2NaCl+H2O2中所有元素的化合价都未发生变化,故A、B、C项错误。
[答案] D
4.(2008年南京)第ⅠA族碱金属元素与ⅦA族元素所形成的化合物具有的性质是
( )
A.当化合物溶于水后,电解其溶液难以得到金属单质
B.熔融状态不导电
C.化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
D.化合物NaCl、KCl、RbCl、CsCl熔点依次升高
[解析] 碱金属离子放电顺序都在H+之后,在水溶液中电解,碱金属离子不会放电,故A项正确。
[答案] A
3.碱金属元素是周期性表现得最鲜明和最规律的一族元素。下列说法正确的是
( )
A.碱金属单质中锂的密度最小,熔点最低
B.碳酸钾溶液的pH<7
C.乙醇与金属钾反应生成氢气
D.用电解铯盐溶液的方法冶炼金属铯
[解析] 碱金属的熔点从上至下趋于降低;K2CO3水解溶液显碱性;电解铯盐溶液应是H+放电得到H2,而得不到金属铯,故A、B、D项错误。
[答案] C
2.碱金属与卤素形成的化合物大都具有的性质是 ( )
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤
C.①④⑤ D.②③⑤
[答案] A
1.红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是 ( )
A.Mg B.Sr
C.K D.Cl
[解析 ] Sr的焰色反应为洋红色。
[答案] B
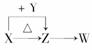
14.X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是__________________________。
(2)X与Y在溶液中反应的离子方程式是______________________________________
________________________________________________________________________。
(3)X含有的四种元素之间(两种、三种或四种)可组成多种化合物,选用其中某些化合物,利用如下图所示装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
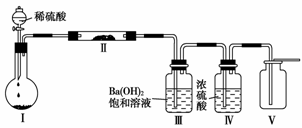
①装置Ⅰ中反应的化学方程式是____________,装置Ⅱ中物质的化学式是________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中的气体,该化合物的化学式是________________,所需仪器装置是________(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是_______________________________________________
________________________________________________________________________。
[解析] (1)X、Y、Z、W都是短周期元素组成的化合物;X、Y、Z都是钠的化合物。W是CO2,X是NaHCO3,Z是Na2CO3,Y是NaOH。
(2)①由于X(NaHCO3)中所含元素是钠、氢、碳、氧,装置Ⅲ中生成的白色沉淀是BaCO3;装置Ⅰ中的固体是Na2CO3或NaHCO3;装置Ⅱ中的固体是Na2O2。
②当由上述四种元素中的两种元素组成的化合物,该化合物在催化剂的作用下,通过上述装置收集到比空气重的气体(O2),该化合物为H2O2,发生反应为2H2O22H2O+O2↑,发生装置为Ⅰ,除杂(或干燥)装置选Ⅳ,集气装置选Ⅴ。
(3)依题意和平时所掌握的知识可知,将氯气通入到Na2CO3溶液中的反应产物是:NaHCO3、NaClO、NaCl。
[答案] (1)∶ ∶∶C∶∶ ∶
(2)HCO+OH-===CO+H2O
(3)①Na2CO3+H2SO4===Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4===Na2SO4+2CO2↑+2H2O Na2O2
②H2O2 Ⅰ、Ⅳ、Ⅴ
(4)2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com