
题目列表(包括答案和解析)
(共15分)I(8分) (1)(4分)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察 ,定性比较得出结
论。观察两同学的方案,你认为 (填“甲”或“乙”)更合理。 理由
是 。
 |
(2) (4分)丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
II(7分)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
已知下列数据:
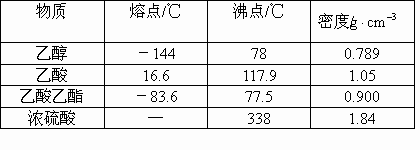
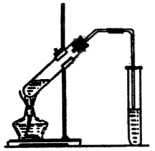
实验室制乙酸乙酯的主要步骤:
在30mL的大试管中按1:4:4的比例配制浓![]() 、乙醇和乙酸的混合液.
、乙醇和乙酸的混合液.
②如图5-22连接装置,使产生的蒸气经导管通到盛有4mL饱和![]() 溶液(加入滴酚酞试液的15mL试管中.)
溶液(加入滴酚酞试液的15mL试管中.)
③小火加热大试管中的混合物
④待小试管收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
⑤分离纯净的乙酸乙酯
请回答下列问题:
(1)如何配制这一定比例的混合液________.
(2)写出该反应的化学方程式________反应中浓![]() 的作用是________.
的作用是________.
(3)在反应装置中,导气管出口的位置在![]() 液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
(4)指出步骤④所观察到的现象是________.
原因与结论是________.
(5)为了提高乙酸乙酯的产率,甲、乙两同学分别设计了如图5-23、图5-24装置,乙同学待反应完毕后,放冷烧瓶中的液体,再用饱和![]() 溶液提取产物,你认为哪种装置合理?为什么?
溶液提取产物,你认为哪种装置合理?为什么?








一.选择题(48分)
1
2
3
4
5
6
7
8
9
10
11
12
B
A
A
D
C
D
A
D
B
A
B
B
13
14
15
16
17
18
19
20
21
22
23
24
D
C
B
B
A
D
A
C
B
B
B
A
25.(7分)略
26.(14分,每个方程式2分)
(1)Ar K (2 )KOH (3)Cl― Al3+
(4)H2O 2K+H2O==2KOH+H2↑
(5)黄 Cl2+2NaBr==2NaCl+Br2
点燃
(6)2Mg+CO2====2MgO+C
(7)Al2O3+2OH―====2AlO2―+H2O
27.(4分)x-8 x+18 x-18 x+8
28.(5分)250mL的容量瓶、烧杯内壁、容量瓶、胶头滴管、相切(各1分)
29.(10分,其中(3)4分,(4)2分,其余每空1分)
(1)乙 亚铁盐在空气中易被氧气氧化 (2) 还原
(3) 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 。
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理
(5) 未能测其成分。
三.计算题(12分)
30.(4分)(1)12 (2)27
31.(8分)(1)2min 末B的浓度为0.7mol?L-1 ,C的浓度为0.6mol?L-1 。
(2) 
 每个计算结果2分,本题共8分。
每个计算结果2分,本题共8分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com