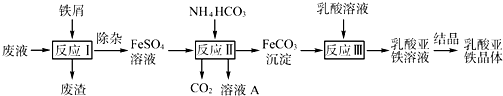
(2009?三明一模)氯化亚铜(CuCl)在石油工业生产中常用作脱硫剂和脱色剂.工业生产氯化亚铜的一种工艺流程如图所示:
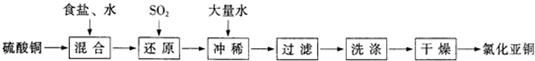
已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl
2-,CuCl
2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl
2-CuCl↓+Cl
-.
(1)往CuSO
4和NaCl混合液中通入SO
2可生成CuCl
2-和硫酸,请写出反应的离子方程式:
2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+
2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+
.
(2)在反应(1)中,温度升至70~80℃,并使用NaCl浓溶液,主要目的是
提高CuCl2-的生成速率
提高CuCl2-的生成速率
.
(3)在反应(1)中,还原剂除了可用SO
2外,还可选用
AB
AB
(填标号).
A.Na
2SO
3 B.Cu C.Ag
(4)过滤所得沉淀须迅速用
95%乙醇
95%乙醇
(填“水”或“95%乙醇”)洗涤、干燥得CuCl成品.
(5)合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去.
[Cu(NH
3)
2]Ac(aq)+CO(g)+NH
3(g)=[Cu(NH
3)
3]Ac?CO(aq)△H<0,生产中为了提高CO的吸收率,可采用的措施是
加压降温
加压降温
.
(6)CuOH不稳定易分解为Cu
2O 298K时,CuOH的K
sp=1.0×10
-14,CuCl的K
sp=1.2×10
-6.把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为
Cu2O
Cu2O
.