
题目列表(包括答案和解析)
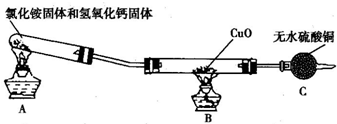
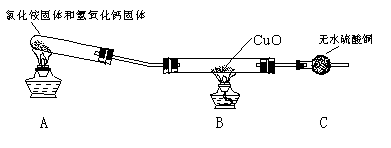
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式:________________________________________________。
(2)实验室还可在__________(填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置图(夹持及尾气处理装置未画出)如下:

(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是__________________________________。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式:_________________________。
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:_____________________________。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取
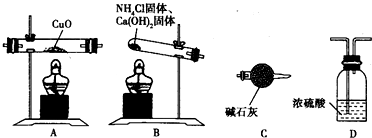
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ?? 。
(2)实验室还可在 ?? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
 该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 ?? 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 ??
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: ??
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为 ?? ,由此得到的结论是 ?? 。
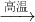 2AlN+3CO
2AlN+3CO
一
题号
1
2
3
4
5
6
7
8
9
10
11
答案
B
D
C
B
B
D
D
C
C
C
A
题号
12
13
14
15
16
17
18
19
20
21
22
答案
D
B
A
C
B
A
C
ABD
BD
AD
BD
必做题
23.实验题
(1). CD (选对一个得2分,对两个得4分,错选得0分)
(2). (Ⅰ)电压表读数变化很小(1分),新电池的内阻很小,内电路的电压降很小.(1分)
.files/image082.gif) (Ⅱ)(1)防止变阻器电阻过小时,电池被短路或电流表被烧坏(或限制电流,防止电源短路). (2分)
(Ⅱ)(1)防止变阻器电阻过小时,电池被短路或电流表被烧坏(或限制电流,防止电源短路). (2分)
(2)R1(1分)
(3)如图所示,有一处画错不给分(2分)
(4).files/image084.gif) (2分)
(2分)
(5)尽可能多测几组U、I值,分别求出每组
的E、r值,最后求平均值(或作U-I 图像
利用图线在坐标轴上截距求出E、r).(1分)
24. 解:(1)设卫星在半径为r的轨道上做匀速圆周运动的速度为v,地球的质量为M,卫星的质量为m。有万有引力提供卫星做圆周运动的向心力:.files/image086.gif) (2分)
(2分)
所以,人造卫星的动能:.files/image088.gif) (2分)
(2分)
卫星在轨道上具有的引力势能为:.files/image038.gif) (1分)
(1分)
所以卫星具有的引力势能为:.files/image091.gif)
所以:.files/image093.gif) (2分)
(2分)
(2)设物体在地于表面的速度为v2,当它脱离地球引力时.files/image094.gif) ,此时速度为零,由机械能守恒定律得:
,此时速度为零,由机械能守恒定律得:
.files/image096.gif) (2分) 得:
(2分) 得:.files/image098.gif) (1分)
(1分)
(3)第一宇宙速度即为绕地球表面运行的速度,故有:
.files/image100.gif) 得:
得:.files/image102.gif) (3分)
(3分)
25. 解:(1)金属棒cd从静止开始运动直至细绳刚好被拉断的过程中有:
Qab =U2t/Rab ① (2分)
QR=U2t/R ② (1分)
联立①②可得Qab=0.4J ③ (1分)
Qcd =I2Rcdt ④ (2分)
Qab + QR =I2RRabt/(Rab+R) ⑤(1分)
联立④⑤可得Qab =0.9J ⑥ (1分)
(2) 细绳被拉断瞬时,对ab棒有:
Fm=mg+BIabL ⑦ (2分)
又有IR=RabIab/R ⑧ ( 1分)
Icd=Iab+Icd ⑨ (1分)
又由闭合欧姆定可得
BLv=Icd [Rcd+RabR/(Rab+R)] ⑩ (2分)
联立⑦⑧⑨⑩可得v=1.88m/s ? (1分)
(3)由功能关系得
Mgh= Q总 +1/2mv2 ? (2分)
即可得h=3.93m ? (1分)
26.(除特殊说明外,每空2分,共18分)
(1)真正 温度 采用温室或大棚生产 减少
|