
题目列表(包括答案和解析)
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下: 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH= 。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是 (填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为 。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是 (填以下选项序号),原因是 。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH= 。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是 (填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为 。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是 (填以下选项序号),原因是 。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
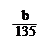 mol
mol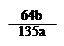 ×100℅
×100℅ 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的_________区;溴的价电子排布式为______________
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是_______
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4? (填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4? (填“>”、 “<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的分子式__________(写出1个)
(6)如图为碘晶体晶胞结构。有关说法中正确的是_____________

A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形?? 成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________

| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
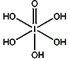 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)

一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
D
B
B
A
A
C
B
C
二、选择题
题号
11
12
13
14
15
答案
A
CD
C
AC
D
三、填空、简答和计算
17.(1) g?mol-1 (2)
g?mol-1 (2)
18.(1)11 mol、10 mol、10 mol;(2)1.204×1023
19.A,A,D,D,
20. 24,40,56
21.据题意有 A + B ==== C + D
16 20 W 4.5
根据质量守恒定律W=16+20-4.5=
A+B====C+D

x=15.75(g)
所以C的摩尔质量为 =
=
22. 设参加反应的锌的物质的量为x, 析出铜的物质的量为y, 生成ZnSO4的物质的量为z.
CuSO4 + Zn = ZnSO4 + Cu 质量增加
1mol 1mol 1mol 1mol
x
z y
解得:x=0.1mol y=0.1mol z=0.1mol
生成ZnSO4的质量:m(ZnSO4)=
答:略。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com