
题目列表(包括答案和解析)
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2 + CO + H2O === Pd↓+ CO2 +2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
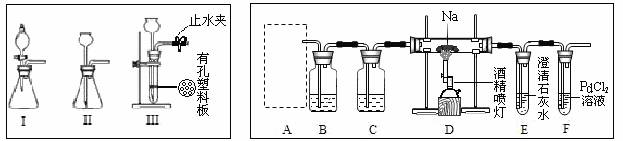
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是_________(填写 “I”、 “II”或“III”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________________。
(2)观察实验装置图可知Na与CO2反应的条件是_____________,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是_____________________。待装置________(填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
② 若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是_____ _____。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
。
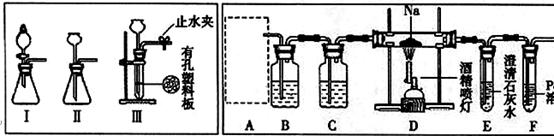
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
 (4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。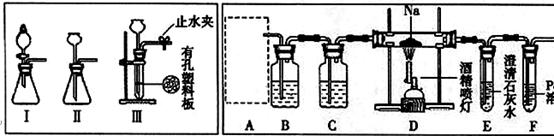
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
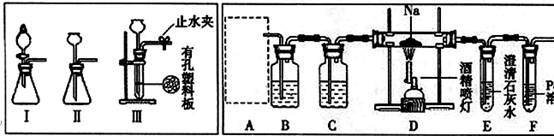
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。[来源:Zxxk.Com]
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
 (4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
1.A(碘单质遇淀粉变蓝色,而不是碘酸钾)
2.D(同温同压下,mg气体A与ng气体B的分子数目相同,说明物质的量相同,A、B、C正确,D同温同压下,气体A与气体B的密度之比等于它们的物质的量之比为m : n)
3.C(从③处导出的气体含有少量SO2、O2 、N2等,不可直接排入大气,否则造成污染)
4.A(B项由于不知道气体的状态,
5.A(放出热量ΔH<0,所以A错误;其它说法均正确)
6.A(水的热稳定性比较高是因为水分子中氢氧键的键能大;金属晶体导电是因为含有自由移动的电子;离子晶体硬度较大、难于压缩是因为离子键键能大)
7.D (D中上下移动时,两端液面始终平衡说明装置漏气)
8.B(过氧化钠固体与水反应,是放热反应,A、C错误;放热使广口瓶中气体温度升高膨胀,则右边升高左边下降)
9.A(ClO-+2I-+2H+===Cl-+I2+H2O;SO+I2+H2O===2I-+SO+2H+,所以可知氧化性为:ClO->I2>SO,因为②中加入过量的Na2SO3 溶液,所以③中含有BaSO3沉淀;①中硫酸只起到酸性作用,②只能证明SO有还原性)
10.C(二元弱酸应分步电离;草酸滴定KMnO4属于氧化还原滴定,不用指示剂;乙二酸脱水分解产物是CO、CO2和H2O)
11.A((NH4)2SO4和CH3COOH明显属于电解质;Cl2是单质既不属于电解质也不属于非电解质;虽然NH3的水溶液能够导电,那是由于生成了一水合氨的原因,故NH3属于非电解质。)
12.D(CsCl和NaCl的阴、阳离子排列方式不同;金属晶体中只有阳离子,没有阴离子;分子晶体中不一定含有共价键如稀有气体)
13.D(①说明有Br-、CO,有CO就没有Fe2+②说明没有SO③说明没有I-)
14.D(能发生这两个电极反应的可能是原电池,也可能是电解池,如果是原电池,则b为铁电极,a为没铁活泼的金属或非金属做电极,电解溶液为含铜离子的溶液;如果是电解池,b用铁做电极和电源的正极相连,a可以和铁相同的电极也可以不同,溶液为含铜离子的溶液)
15.C(A称量时应左物右码,B配制150mL0.10mol/L溶液应用150mL的容量瓶,而且要用玻璃棒引流;D冷凝水的方向应从下进上出)
16.D(①所取浓硫酸的体积少,②③④均造成溶质的损失)
17.问题1:(1)合成氨工业 硫酸工业(其他合理答案也正确) (2分)
问题2:Cu+4H++2NO(浓)===Cu2++2NO2↑+2H2O
3Cu+8H++2NO(稀)===3Cu2++2NO↑+4H2O(其他合理答案也正确)(2分)
化学?第页(见反面)问题3:放热 C(金刚石、s)=C(石墨、s);ΔH=-1.90kJ/mol(2分)
问题4:(1)第二个反应为:Al3++3OH-===Al(OH)3↓ (2分)
(2)最后一个离子反应为:Al(OH)3+OH-===AlO+2H2O (2分)
问题5:4KMnO4+5KI+7H2SO4===4MnSO4+I2+3KIO3+3K2SO4+7H2O (2分) (其他合理答案也正确)
18.(1)①2Cl--2e-=Cl2↑(2分) 用湿润的淀粉-KI试纸靠近Y极支管口(其它合理答案均可)(2分)
②由于2H++2e-=H2↑ 放出氢气,使水的电离平衡向正反应方向移动,使c(OH-)不断增大,所以pH会增大(2分)
③先有白色沉淀生成,继而变成灰绿色,最后变成红褐色(2分)
(2)①A(1分) ②B(1分)
19.(每空2分)(1)NaI NaClO
(2)2I-+ClO-+H2O===I2+Cl-+2OH- I2+5ClO-+2OH-===2IO+5Cl-+H2O
(3)Cl2+2NaOH===NaClO+NaCl+H2O
20.(1)KClO3 (1分) H????????H(1分)
(2)①关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段稳定的水柱,则证明I气密性良好。 (或用止水夹夹住c处,向分液漏斗中加水,打分液漏斗的活塞,若分液漏斗中的水不再下流,则证明I气密性良好。)(2分)
②MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
③S2-+Cl2===S↓+2 Cl-(2分)
化学?第页 ④II III(1分) 除去氯气中的水蒸气(或干燥氯气)(1分)
(3)Cl2+H2O2===2HCl+O2(2分)
21.(1)7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L (每个2分)
解析:解答此题的关键是第(1)问.可根据得失电子数相等确定生成物NaCl、NaClO、NaClO3的物质的量之比,进而确定化学方程式中化学计算数.
(1)依题意可设生成NaClO的物质的量为4mol,NaClO3的物质的量为1mol,设生成NaCl的物质的量x,根据得失电子的物质的量相等,有:1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化学计量数之比与生成对应物质的物质的量相等,即等于9∶4∶1.据此可写出总的化学字方程式:7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com