
题目列表(包括答案和解析)
 H2O+NH3↑
H2O+NH3↑下列离子方程式正确的是( )
A.氯化铵与氢氧化钠两种浓溶液混合加热:NH++OH-![]() NH3↑+H2O
NH3↑+H2O
B.溴化钠溶液中通入氯气:Br-+Cl2=Br2+Cl-
C.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.将石灰石放入稀盐酸中:CO32-+2H+=H2O+CO2↑
A.氯化铵与氢氧化钠两种浓溶液混合加热OH-+NH4+
| ||||
| B.碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
| C.氢氧化镁与稀硫酸反应 H++OH-═H2O | ||||
| D.单质铜与稀硝酸反应 Cu+2H++2NO3-═Cu2++2NO↑+H2O |
Ⅱ.实验室制备氨气,下列方法中适宜选用的是________。
①固态氯化铵加热分解,②固体氢氧化钠中滴加浓氨水,③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氢氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
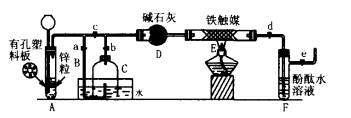
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图15所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E.继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管 E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是________,C瓶内气体的成分是________。
(3)在步骤③中,先加热铁触媒的原因是________。反应管E中发生反应的化学方程式是________。
一、选择题
1―5 BDACB 6A 7C 8D 9B 10A 11B 12D 13C
二、选择题
14.ABD 15.BC 16.D 17.B 18.AD 19.AD 20.B 21.CD
第Ⅱ卷(非选择题 共10大题,共174分)
22.Ⅰ.(共6分,每空3分)
 (1)0.820 (2)16.98
(1)0.820 (2)16.98
Ⅱ.(共12分)
①(4分)
②串(2分) 290Ω(3分).③偏大(3分)
23.(16)
(1)a=g(sinα-μcosα)
=5.76m/s2 ----(5分)
(2)Lsinθ=gt2/2 ----(2分)
Lcosθ=V t ----(2分)
V=30m/s ----(2分)
(3)mgh-w=mV2/2 ----(3分)
w=1200J ----(3分)
24. (18分)
(1)L=V0t ----(1分)
d=at2/2 ----(1分)
a=qU/md ----(2分)
U=2mV02d2/qL2 ----(2分)
(2) Vy=at ----(1分)
V=V0/cosθ ----(1分)
tanθ= Vy/ V0 ----(1分)
R=L/2sinθ ----(1分)
qVB=mV2/R ----(2分)
B=4mV0d/qL2 ----(2分)
(3)根据带电粒子在磁场及电场中运动的对称性易知:带电粒子再次进入电场并再次从电场中飞出的速度为V0,方向水平向左. ----(4分)
25. (20分)
(1) m1s1-m3s3=0 ----(2分)
S1=R ----(2分)
S3=0.05m ----(2分)
(2) m1gR=m1V12/2+m3V32/2 ----(2分)
m1V1-m3V3=0 ----(2分)
(m1+m2)V22/2+m3V32/2-μ(m1+m2)g CD=Epm ----(2分)
Epm=0.45J ----(2分)
(3)(m1+m2)V22/2+m3V32/2=μ(m1+m2)gS ----(2分)
S=0.25m ----(2分)
所以m1、m2最后停在CD的中点 ----(2分)
26.(12分)(1)NH4HCO3 或者(NH4)2CO3(3分), NO2(3分)
(2) 4NH3+5O2 4NO +6H2O(3分)
4NO +6H2O(3分)

(3)3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O(3分)
27.(15分)
(1)C:
 (2分) B:第三周期,第IIIA族(2分)
(2分) B:第三周期,第IIIA族(2分)
(2)
 (3分)
(3分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(3分)
(4)取一个烧杯,加入20mL蒸馏水,加热至沸,然后向沸水中滴加FeCl3饱和溶液
1mL~2mL,继续煮沸,待溶液呈红褐色为止;(3分)
(5)观察溶液的颜色(2分);
28(18分)(1)C4H8O2(2分)
(2)CH3CH2COOCH3 CH3COOCH2CH3 HCOOCH(CH3)2 HCOOCH2CH2CH3(各1分,共4分)
(3)取代反应 消去反应(各1分,共2分)
(4)CH3
 CH3 CH3CHO CH3
CH3 CH3CHO CH3 CH=CH2(各2分,共6分)
CH=CH2(各2分,共6分)
(5)2 -COOH+CH3
-COOH+CH3
 CH3
CH3
 -COO
-COO OC-
OC- +2H2O(2分)
+2H2O(2分)
(6)CH3
 CH3(2分)
CH3(2分)
29.(15分) (1)(6分 ) Na2CO3 Ba(OH)2 AgNO3
(2)(3分) Al3+ + 3H2O  Al(OH)3 + 3H+
Al(OH)3 + 3H+
(3)(3分)c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-)
或c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)
(4)(3分) 0.01mol
30.Ⅰ(1)多 B (2)弱 A (3)弱 C
II.(1)细胞分化(或基因的选择性表达) (2)线粒体 组织液 (3)胰高血糖素 0
(4)糖蛋白 ⑸乙细胞已高度分化,不再进行有丝分裂,所以看不到染色体
31.(1)酸味 aabb AaaBbb AaBb(2)甜味 AaBb 4 1/16
(3)aabb 果实酸味、子叶狭窄 aaBb
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com