
题目列表(包括答案和解析)
( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
①反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g)  B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
 (3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
(3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
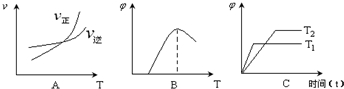
 ).
).实验题:(本题共12分)
(1)用18.4mol/L的浓H2SO4配制100ml浓度为1mol/L的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50ml蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30ml蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心倒入100ml容量瓶里;
D.检查100ml容量瓶口部是否会发生滴漏;
E、用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F、盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G、用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写) 。
②进行A步操作时,应选择下列量器 (填序号)
a、10ml量筒 b、50ml量筒 c、100ml量筒
③如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度
将 (偏高、偏低、无影响)
④进入A步操作后,必须 后才能进行C操作。
(2)只从下列试剂中选择实验所需的试剂,采用两种不同的方法区分0.1mol/L的H2SO4和0.01mol/LH2SO4溶液,简述其操作过程:
试剂:紫色石蕊试液、酚酞试液、甲基橙试液、蒸馏水、BaCl2溶液、pH试纸、0.1mol/L Na2S2O3溶液
方法一:
。
方法二:
。
题目
(12分)实验室要用NaCl固体配制100mL 0.4mol·L-1的NaCl溶液,回答下列各题:
(1)实验中需要用到的仪器有:托盘天平、烧杯、玻璃棒、量筒、药匙,还缺少的玻璃仪器有___________________________;
(2)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
其正确的操作顺序应是______、 、A、G、C、G 、 (填各步骤序号);
(3)通过计算可得出可用托盘天平称取NaCl固体______________克;
(4)下列操作对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①摇匀后发现液面低于刻度线再加水:________________
②容量瓶中原有少量蒸馏水:________________
③定容时俯视观察液面:________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com