
题目列表(包括答案和解析)
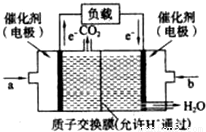
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 2 | 4 | 0.9 | t |
 、一个
、一个 、一个
、一个 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸,其中一种的结构简式为
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸,其中一种的结构简式为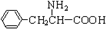 .另一种水解产物结构简式为:
.另一种水解产物结构简式为:

 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯( )和CH3OH,则醇X的结构简式为
)和CH3OH,则醇X的结构简式为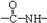 、一个
、一个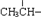 、一个
、一个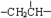 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸,其中一种的结构简式为
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸,其中一种的结构简式为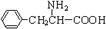 .另一种水解产物结构简式为:______,2分子该有机物一定条件下失去2分子水可以生成含有6元环的化合物,对应反应方程式为:______.
.另一种水解产物结构简式为:______,2分子该有机物一定条件下失去2分子水可以生成含有6元环的化合物,对应反应方程式为:______.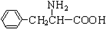 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(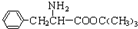 )和CH3OH,则醇X的结构简式为______.
)和CH3OH,则醇X的结构简式为______.
| ||
| ||
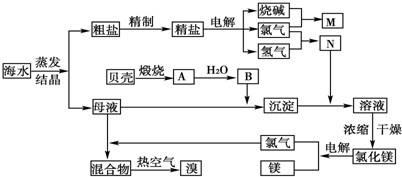
| ||
| ||


2- 4 |
一.选择题(48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
A
C
B
C
B
B
题号
9
10
11
12
13
14
15
16
答案
A
D
C
C
B
B
D
A
二.非选择题(52分)
17.(1) .
. (2)
(2) .
. (3)
(3)
(4) (每空2分,答错或少答1个扣1分,扣到0分为止)
(每空2分,答错或少答1个扣1分,扣到0分为止)
18.(1)验证锂.钠.钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强)(2分);c(1分)
(2)① (各1分)
(各1分)
② (或
(或 (2分)
(2分)
19.(1)第三周期 ⅦA(1分)
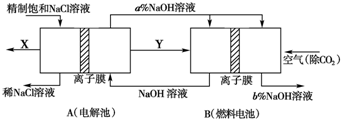
(2) 氯碱(2分)
氯碱(2分)

(3)
(4) ;
; KJ/mol(2分)
KJ/mol(2分)
或 ;
; KJ/mol
KJ/mol
(5)离子晶体(1分)
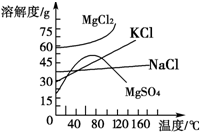
20.(1)硫  离子键.非极性键(4分)
离子键.非极性键(4分)
(2) (2分)
(2分)
(3)① (2分)
(2分)
② (2分)
(2分)
21.(1)
(2)分液漏斗(1分)
(3)饱和食盐水(或饱和氯水)(1分)浓硫酸(1分)
(4) (1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(5)使生成的 升华,与其他固体分离(2分)
升华,与其他固体分离(2分)
(6)吸收多余的 ,防止污染空气(1分)
,防止污染空气(1分)
(7)连接 的导管易被
的导管易被 固体堵塞(2分)
固体堵塞(2分)
22.(1)0.16 (2)0.03 0.05 (3)5.72
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com