
题目列表(包括答案和解析)
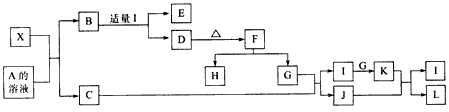
 4X+SiC+3C。
4X+SiC+3C。 | A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |





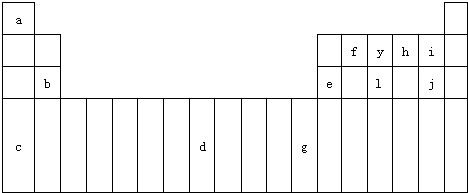
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
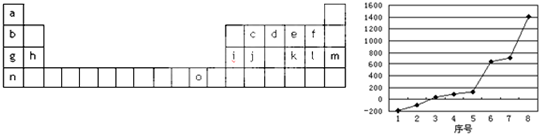
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
 五、19、(10分)(1)
(2分)
五、19、(10分)(1)
(2分)
(2)Na+ (2分)
(3)由于HF中含有以氢键相结合的聚合氟化氢分子(HF)n (3分),(其它合理答案参考给分)
(4)Na3AlF6 (3分)
20、(10分) (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)
(4) A (2分,有错不给分)
(5)  (2分)
(2分)
六、21、(10分)(1)H+ + OH― = H2O, CO32― + H+ = HCO3― (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为:0.015mol
*
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com