
题目列表(包括答案和解析)
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:
(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知: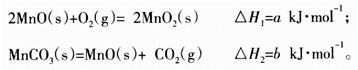
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
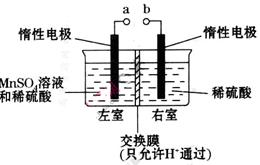
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示: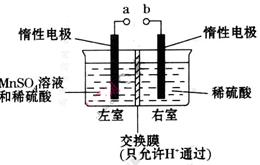
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为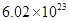 个,左室溶液中
个,左室溶液中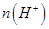 的变化量为________________。
的变化量为________________。


 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。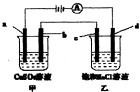 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.设在电解过程中产生的气体全部逸出,下列说法正确的是( )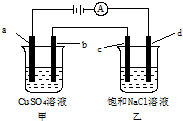 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是
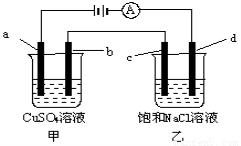
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH――4e- = O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况下)
第Ⅰ卷(选择题 共48分)
题号
1
2
3
4
5
6
7
8
答案
A
C
C
C
B
B
A
D
题号
9
10
11
12
13
14
答案
AB
D
C
B
BD
CD
第Ⅱ卷(非选择题部分 共72分)
15.(10分)(1)①B(1分) ②蒸馏烧瓶(1分) ③气密性检查(2分)
④大气压(或开始时烧瓶内的压强)(1分) 强(1分)
开始一段时间内曲线a的变化值大于曲线b。(2分)
(2)①有利于控制氧气的量 ②有利于二氧化锰的回收
③有利于控制氧气的生成速率(答出任意两点即可,每空1分)
16.(12分)(1)② 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- (2分)
 |
⑤ NH4++HCO3-+2OH- CO32-+NH3↑+2H2O(2分)
(2)过滤(1分) 加热(1分) (3)碱石灰(或硅胶)(1分)
(4)AlN(2分) 配位键(1分)
(5)产生等量的NH3时,(NH4)2CO3所消耗的NaOH的量是NH4HCO3一半。(2分)
17.(10分)⑴ 0.125 4.69 ⑵增大 > ⑶0.25 不变 (以上每空1分)
(4)6 1.25 (每空2分)
18.(10分)(1)②⑥(2分)
(2)C: (1分) F:
(1分) F:
 (1分)
(1分)
(3)
|