
题目列表(包括答案和解析)
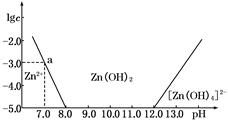
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| X值 | 0.98 | 1.57 | 3.04 | 3.44 | 3.98 | 0.93 | 1.31 | 1.61 | 2.19 | 2.58 |


 H-Cl+HO-Br.
H-Cl+HO-Br.(10分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出14种元素的X的数值:
| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
1-8 B A A C B C C D
9-14 D BC C AD B CD
15.(10分)
⑴<(1分)
⑵K =  变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
⑶减小 不变 (1+1分)
⑷> 压强增大后,C可能已经液化或者固化 (1+2分)
16.(13分)
⑴略(2分)
⑵酚酞 无色变成浅红色(2分)
⑶碱式滴定管 锥形瓶(2分)
⑸1 滴定管只用水洗,未用NaOH润洗 滴定前滴定管尖嘴处有气泡,滴定后消失 滴定终点判断不准,溶液呈红色(其他合理答案也可以)(1+2 + 2分)
⑹0.1200mol/L (有效数字1分)(2分)
17.(9分)
⑴还原 使与空气充分接触将MnO2充分氧化(1+ 2分)
⑵2H+ + 2e― = H2↑(或2H2O + 2e― = H2↑+ 2OH―) MnO42― ― e― = MnO4―
2K2MnO4
+ 2H2O  2KMnO4 + 2KOH + H2↑(2+2+2分)
2KMnO4 + 2KOH + H2↑(2+2+2分)
18.(10分)
⑴略 H2O2 + SO2 = H2SO4(1+ 2分)
⑵HS―+ H2O H2S
+ OH―(2分)
H2S
+ OH―(2分)
⑶H+ + HSO3― = H2O + SO2↑(2分)
⑷负 O2 + 2H2O + 4e― = 4OH―(1+ 2分)
19.(9分)
⑴2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
⑵2Al+2OH―+2H2O=2AlO2-+3H2↑(2分)
⑶①4OH--4e-=2H2O+O2↑(2分)
②H+放电,促进水的电离,OH-浓度增大(2分)
③B(1分)
20.(12分)
⑴碱性 A2―将发生水解 A2―+ H2O  HA― + OH―(1+ 2分)
HA― + OH―(1+ 2分)
⑵ABCD(4分 少1个,扣2分,少2个扣3分,只答对1个或未答0分)
⑶< H
⑷c(Na+)> c(HA―)> c(H+)> c(A2―)> c(OH―) (2分)
21.(9分)
小(2分)
⑴D 混合物中有砖红色沉淀生成(1+ 2分)
⑵由AgCl、Ag2CrO4的溶度积常数计算可知道,AgCl溶解度更小,加硝酸银
所以当Cl―全部被消耗时,混合体系的总体积约为40mL,此时
c(CrO42―) =  =5.26×10―4 mol/L
=5.26×10―4 mol/L
c(Ag+) =  =6×10―5 mol/L(AgNO3过量很少即可)
=6×10―5 mol/L(AgNO3过量很少即可)
c(Cl―) =  = 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
= 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com