
题目列表(包括答案和解析)
盐酸阿立必利是一种强效止吐药。它的合成路线如下:

(1)有机物D中含有的官能团有酯基、 、 。
(2)由E生成F的反应类型为 。
(3)写出同时满足下列条件的D的一种同分异构体G的结构简式: 。
①属于α-氨基酸; ②不能与FeCl3溶液发生显色反应;
③1molG与足量的钠反应生成1molH2 ④分子中有一个手性碳原子,有6种不同化学环境的氢。
(4)高聚物H由G通过肽键连接而成,H的结构简式是 。
(5)写出由C生成D的化学方程式: 。
 (6)已知:
(6)已知:![]() 。请写出以
。请写出以 、CH3CH2CH2COCl、CH3OH为原料制备
、CH3CH2CH2COCl、CH3OH为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下
|
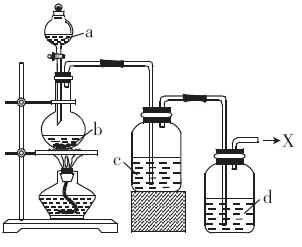
浓盐酸与重铬酸钾[K2Cr2O7(s)]共热时产生某种气体单质X,产物中还有三氯化铬等生成。这种方法制X时便于控制反应,撤去酒精灯则反应停止。现在要制得纯净的X(装置如图)。

(1)加热时,a与b反应的化学方程式__________________________________
(2)液体C的作用是_____________________________________________
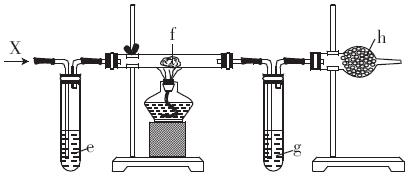
现在把制得的纯净干燥的X通入下图所示的装置。

(3)e是FeBr2溶液,一段时间后观察到的实验现X象是________________________________
(4)f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,则大试管内发生反应的化学方程式为________________________
(5)g是水和CCl4的混合物,可看到颜色较深的液体在____ (填“上”或“下”)层.
(6)h是碱石灰,则此装置的作用是______________________________________________
现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉。已知反应2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O;ΔH<0,温度稍高即发生副反应6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O。甲、乙、丙三人分别设计一个实验装置,如图所示。
(1)请指出三个装置各自的缺点或错误(如没有可不填):
甲__________________________________________________________。
乙__________________________________________________________。
丙__________________________________________________________。
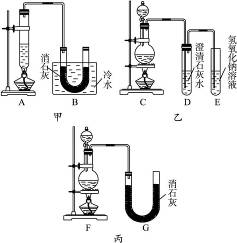
(2)图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号)______________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15 mol,其可能的主要原因是____________________。(假定各步反应均无反应物损耗且无副反应发生)
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)

(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系

①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com